
题目列表(包括答案和解析)
17.(12分)
(1)下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号。错选倒扣分,至本小题扣完为止)。
A.用干燥的pH试纸测定氯水的pH
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸不会产生沉淀
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
②步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
;
 ③步聚2中,判断加入BaCl2已过量的方法是:
③步聚2中,判断加入BaCl2已过量的方法是:
;
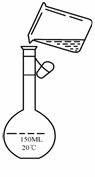
④为检验精盐纯度,需配制100 mL 0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是 、 。
16.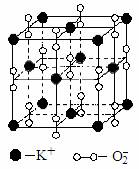 高温下,超氧化钾晶体呈立方体结构。晶体中氧的
高温下,超氧化钾晶体呈立方体结构。晶体中氧的
化合价部分为0价,部分为-2价。如图为超氧化钾晶
体的一个晶胞(晶体中最小的重复单元)。则下列说法
正确的是
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
15.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是。
A.CN-可以和水反应生成HCN B.CN-可被I2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原
D.HCN的电子式为 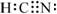
14.下列画有横线的物质,在反应中不能完全消耗的是
A.将含少量H2O(g)的 H2 通过盛有足量Na2O2的容器中并不断用电火花点燃
B.将1molCu置于含2molH2SO4的浓硫酸中加热
C.在强光持续照射下,向过量的Ca(ClO) 2溶液中通入少量的CO2
D.在一定条件下3体积H2和1体积 N2 在催化剂存在下反应
13.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.L、M的单质与稀盐酸反应速率:M >L
B.R的氧化物对应的水化物可能具有两性
C.T的气态氢化物分子间存在氢键
D.L、Q形成的简单离子核外电子数相等
12.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径由小到大的顺序为:W<X<Y<Z
C.X与W可以形成W2X、W2X2两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
11.设NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,11.2L氦气所含的原子数为NA
B.1.6gNH2-离子中所含的电子数为NA
C.常温常压下,44g二氧化碳分子中所形成的共用电子对数为2NA
D.NA个氮分子和NA个氢分子的体积比是1︰1
10. 一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
9. HgCl2的稀溶液可以用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有微弱的导电能力,下列关于HgCl2的叙述正确的是
A.HgCl2属于离子化合物 B.HgCl2属于共价化合物
C.HgCl2属于非电解质 D.HgCl2不能使蛋白质变性
8.已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 KJ/mol
下列结论正确的是
A.①的反应热为221 KJ/mol
B.碳的燃烧热大于110.5 KJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为57.3KJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3KJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com