
题目列表(包括答案和解析)
18.(12分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl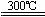 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000-1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,且在空气中易自燃。
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,如果考虑用分馏的方法提纯SiHCl3,则应从资料中查阅的数据是 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
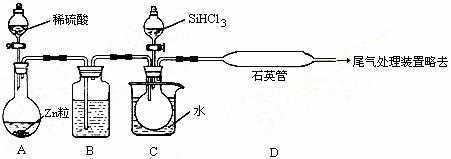
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功和安全,操作的关键是:检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液,向其中应加入合适的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaCl溶液 d.KSCN溶液 e.Na2SO3溶液
17.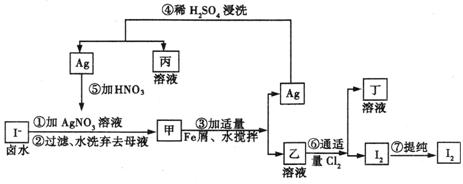 (10分) 在已经提取氯化钠、溴、镁等化学物的富碘卤水中,采用下图所示的工艺流程生产单质碘。
(10分) 在已经提取氯化钠、溴、镁等化学物的富碘卤水中,采用下图所示的工艺流程生产单质碘。
回答下列问题:
(1)写出乙溶液中溶质的化学式 。
(2)第④步操作中的用稀H2SO4浸洗的目的是 。
(3)进行第⑦步操作的两种方法是 或 (不要求写具体步骤)。
(4)实验室检验单质碘存在的方法是 。
(5)用化学方程式表示甲物质见光变黑的原因 。
16.下列表格中的各种情况,可以用下面的图象曲线表示的是
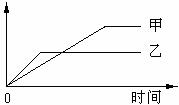
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与足量水反应 |
H 2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3 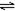 N2+3H2 N2+3H2 |
氨气的转化率 |
500℃ |
400℃ |
|
C |
在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2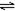 2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2molSO2与lmolO2,在相同温度下2SO2+O2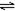 2SO3 2SO3 |
SO3物质的量 |
10个大气压 |
2个大气压 |
第II卷(非选择题,共86分)
15.铜与1mol/L的硝酸反应,如果NO3一浓度下降0.2mol/L,则溶液中c(H+)同时下降(溶液体积变化忽略不计)
A.0.2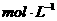 B.0.4
B.0.4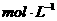
C.0.6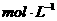 D.0.8
D.0.8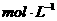
14.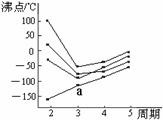 右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S
B.SiH4
C.PH3
D.HCl
13.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量CO2通入Ba(OH)2溶液 |
过量CO2通入少量Ba(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入0.2molFeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
12.常温下,下列各溶液中,微粒的物质的量浓度关系正确的是
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
11.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
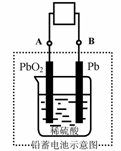 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由A到B
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
10.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。 ③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。 ④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1-离子是否存在 D.不能确定HCO3-离子是否存在
9.下列各选项所述的两个量,前者一定大于后者的是
①F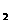 和Br
和Br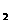 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO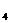 和CuSO
和CuSO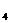 · 5H
· 5H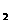 O的质量
O的质量
④25℃时,等体积且pH都等于5的盐酸和AlCl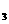 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH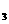 +NO-→ N
+NO-→ N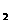 +H
+H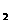 O(未配平)反应中,被氧化和被还原的N原子数
O(未配平)反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点 ⑦H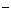 和H
和H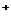 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com