
题目列表(包括答案和解析)
3.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.硫酸钡 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
2.下列物质不能直接由单质化合得到的是
A.CuCl2 B.FeCl2 C.FeS D.Na2O2
1.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是 ( )
A.加热 B.滴加少量的CuSO4溶液
C.不用稀硫酸改用98%的浓硫酸 D.不用铁片改用铁粉
25.(10分)铝是国民经济发展的重要材料, 铝在地壳中含量约占8%,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
(1)工业上制取铝的流程图如下:

在制取氧化铝中,分析铝土矿和赤泥所得数据如下:
|
|
Al2O3 |
Fe2O3 |
NaOH |
其它杂质 |
|
铝土矿 |
55% |
16% |
0 |
/ |
|
赤泥 |
15% |
48% |
8% |
/ |
设其它杂质不参加反应,则每生产1 t 纯净氧化铝,需铝土矿的质量为 吨, 投入的烧碱固体为 吨。
(2)国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%-5.5%,Cu-1.0%-1.5%,Mg-0.4%-0.6%,其余为Al。现对某铸造铝合金产品的质量进行如下实验检测:①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。
请通过计算判断该品牌的铸造铝合金是否为合格产品。
24.(8分)某化合物中含X、 Y 、Z三种元素,其中有两种金属元素,X为其中一种,其原子个数组成比是X:Y:Z=1:2:4。将1.98g该化合物溶于水,滴加适量的稀硫酸后,再加入1.12g还原铁粉,恰好完全反应,铁元素全部以Fe2+存在。向反应后的溶液中加入适量的KOH溶液,使Fe2+刚好沉淀完全,过滤,将沉淀充分加热后,得到红色Fe2O3粉未2.4g。将滤液在一定条件下蒸干,只能得到一种纯净且不含有结晶水的含氧酸盐(不为复盐)6.96g。试通过计算推断该化合物的化学式。
23.(10分) 不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
22.(10分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。

(1)写出E的电子式:E 。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,反应的化学方程式为 _________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:______________。说明阴极附近溶液颜色逐渐变红的原因 。
21.(8分) (Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g);反应达到平衡后,再恢复至原温度。
2C(g);反应达到平衡后,再恢复至原温度。
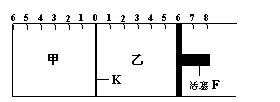 回答下列问题:
回答下列问题:
(1)可根据 现象来判断
甲、乙中反应都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度
左侧a处,则a的取值范围是 。
(Ⅱ)若一开始就将K、F固定,其它条件均同(Ⅰ),则达到平衡时:
(1)甲、乙中C的物质的量的关系是甲 乙(填:“>”或“<”或“=” );
(2)如果测得甲中A的转化率为b,则乙中C的转化率为 ;
20.(10分)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
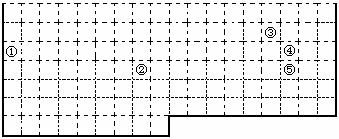
(1)请在上表中用实线补全元素周期表边界,并画出金属元素与非金属元素的分界线。
(2)写出元素②在周期表中的位置 。
(3)根据元素①氢化物的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(4)类似③④这种对角相邻位置的一些元素在性质上具有一定的相似性,如③和④元素的最高价氧化物的水化物均为强酸。写出与元素⑤对角相似的元素的最高价氧化物水化物的化学式 。
(5)元素周期表中蕴含着许多的变化规律。请你写出与周期表相符合的一条一般规律:
。
19.(8分)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,同时PI3易水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式: ;
(2)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的体积不变,则所配制HI溶液的物质的量浓度不会变化。其原因是(用化学方程式表示): ; 。
(3)除了配制氢碘酸溶液时,需要加入抗氧化剂红磷外,其他一些溶液配制时也需要加入抗氧化剂,请例举一个例子,写出溶液和抗氧化剂的名称 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com