
题目列表(包括答案和解析)
10.某一无色溶液,若向其中加入铝粉,有气体放出,则该溶液可能大量存在的一组离子是
A.Fe2+、H+、NO3-、Na+ B.OH-、Br-、SO42-、Na+
C.SO42-、Br-、OH-、Fe3+ D.H+、Br-、CO32-、K+
9.合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要20-50 MPa的高压和500℃的高温,用铁作为催化剂。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下用氮气和氢气合成出氨。下列说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成比哈伯法合成,能节约能源,具有很好的发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂降低了反应的活化能,提高了活化分子百分数
8.将饱和硫酸铜溶液分成两等份,一份维持温度不变加入少量无水硫酸铜粉未,另一份升温至50 ℃,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu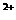 的数目
的数目
7.室温下,在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D.1∶9
6.阿伏加德罗常数约为6.02×1023 mol-1,下列说法中正确的是
A.1 L 0.1 mol/L的CH3COOH中H+的数目等于6.02×1022
B.7.8 g Na2O2固体中含阴离子的数目为6.02×1022
C.标准状况下,11.2 L 四氯化碳中所含分子数为3.01×1023
D.l mol SiO2固体中含有Si-O键的数目为1.204×1024
5. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,下列说法正确的是
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,下列说法正确的是
A.N4属于一种新型的化合物 B.N4转化为N2属于物理变化
C.N4沸点比P4(白磷)高 D.N4与N2互为同素异形体
4.下列反应的离子方程式表示正确的是
A.澄清石灰水中通入过量二氧化碳:OH-+ CO2 = HCO3-
B.铜片跟三氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
C.碳酸钙跟醋酸反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.Fe3O4与稀HNO3反应:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
3.下列说法错误的是
A.胶体能发生电泳现象是由于胶体粒子带电
B.治疗肾功能衰竭等疾病,常将病人的血液进行透析,透析的原理与渗析相似
C.纯铁的熔点比生铁的高
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
1. 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
A.用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.回收废电池,减少对环境的污染
C.为使农作物高产,大量施用化肥和农药
D.推广垃圾分类存放,分类回收,分类处理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com