
题目列表(包括答案和解析)
20.(13分)现有下列短周期元素性质的有关数据:
|
元素编号 |
a |
b |
c |
d |
e |
f |
g |
h |
i |
j |
|
原子半径/pm |
111 |
77 |
70 |
104 |
143 |
99 |
117 |
186 |
160 |
64 |
|
最高化合价或 最低化合价 |
+2 |
-4 |
-3 |
+6 |
+3 |
-1 |
+4 |
+1 |
+2 |
-1 |
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||
|
1 |
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
||
|
3 |
|
|
|
|
|
|
|
|
||
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_____ __。
(3) i在b的氧化物中燃烧的方程式为 。
(4) h和d所形成的化合物的电子式为 。
(5)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式____________。
19.(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?________________________________
(2)为什么不用普通滤纸过滤器过滤?________________________________________
(3)如何保证在70℃~80℃条件下进行滴定操作:______________________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_______
A.H2C2O4•2H2O B.FeSO4•7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4•2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4•2H2O =2Mn2++10CO2↑+18H2O
问:
①滴定时,高锰酸钾溶液应装在________________;
②滴定终点标志是____________________;
③KMnO4溶液的物质的量浓度为_______________;
④若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或偏低“)
18.(9分)现行高中化学教材(必修加选修)中对铝与氧化铁发生的“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒。”“纸漏斗的下部被烧穿,有熔融物落入沙中。”
(1)写出上述“铝热反应”的化学方程式__________________________________
(2)完成下列探究方案:
猜想:熔融物的主要成分可能是铁铝合金
探究过程:
|
实验步骤 |
实验现象 |
主要化学方程式 |
|
|
|
|
17.(4分)下列有关化学实验的基本操作及安全知识的叙述,错误的是 (填序号)。
A.用托盘天平称取10.50 g干燥的NaCl固体
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方,
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.中和热的测定实验中,可用金属丝(棒)代替环形玻璃棒
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
G.采取降温结晶可以提纯混有少量氯化钠的硝酸钾
H.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
16.室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,
曲线如下图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
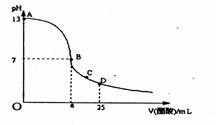 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+)+ c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= 0.2 mol/L
第Ⅱ卷(非选择题,共86分)
15.铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的H2SO4和NaOH的物质的量之比为
A.1∶1 B.2∶1 C.3∶2 D.2∶3
14.下列实验中,最终溶液颜色有明显变化的是
A.往NaOH溶液中加入少量明矾溶液
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.往FeSO4溶液中滴入少量KSCN溶液
D.往NaHSO3溶液中加入少量Na2O2固体
13.我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:LaNi5H6
+ 6NiO(OH)  LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.放电时,电子由负极通过外电路流向正极
D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
12.已知:101 k Pa时辛烷的燃烧热为5518 kJ · mol-1,强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,则下列热化学方程式书写正确的是
① 2C8H18( l ) + 25O2(g) = 16CO2(g) + 18H2O(g);△H = -11 036 kJ · mol-1
②2C8H18( l ) + 25O2(g) = 16CO2(g) + 18H2O(l);△H = -11 036 kJ· mol-1
③ H+ + OH- = H2O;△H = -57.3 kJ · mol-1
④ 2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) +2 H2O( l );△H = -114.6 kJ · mol-1
A.①③ B.②③ C.②④ D.只有②
11.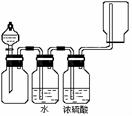 下图装置可以用来发生、干燥、收集(不考虑尾气处理)气体。该装置适用于
下图装置可以用来发生、干燥、收集(不考虑尾气处理)气体。该装置适用于
A.锌和盐酸生成氢气
B.高锰酸钾和浓盐酸生成氯气
C.生石灰与和浓氨水生成氨气
D.过氧化钠和水生成氧气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com