
题目列表(包括答案和解析)
5.有M、R两种主族元素,已知M 离子与R
离子与R 离子核外电子数之和为20,则下列说法不正确的是
离子核外电子数之和为20,则下列说法不正确的是
A.M与R的质子数之和一定等于19 B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期 D.M和R的质子数之差可能等于7
4.某原子的4d亚层中有1个电子,其第五电子层中共有的电子数为
A.0 B.2 C.3 D.8
3.分别取80℃的等质量的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水),下列关于甲、乙溶解度的叙述中肯定正确的是
A.20℃时乙的溶解度比甲大 B.80℃时甲的溶解度比乙大
C.温度对乙的溶解度影响较大 D.温度对甲的溶解度影响较大
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是
A.2 B.3 C.4 D.5
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
A.18O 31P 119Sn B.27Al 19F 12C
C.元素周期表中VA族所有元素的原子 D.元素周期表中第I周期所有元素的原子
25.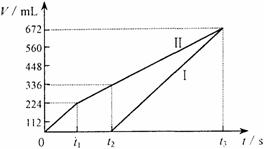 (10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
24.(10分)向碳酸镁和硫酸钠的混合物中,加足量盐酸完全溶解后,在标准状况下,收集到0.56 L二氧化碳。向反应后的溶液中加入足量的氢氧化钡溶液,可得到6.11 g沉淀。试求:原混合物中碳酸镁和硫酸钠的质量。
23.(10分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
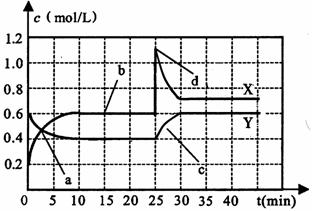 根据上图,回答下列问题:
根据上图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示N2O4浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)25 min~30 min内用NO2表示的平均化学反应速率v(NO2)= mol/(L·min);反应进行至25 min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 。
A、升高温度 B、缩小容器体积 C、加入催化剂 D、加入一定量的N2O4
22.(8分)(1)肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是 ,正极的电极反应式是 。传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(2)金属铌(Nb)能与卤素形成簇状化合物,其特点是六个Nb原子形成八面体骨架,卤原子通过双桥基(-X-)或三桥基(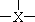 )与Nb原子相连,结构单元之间通过双桥基相连。下图为一种NbaXb的结构单元,试写出该物质的化学式:
)与Nb原子相连,结构单元之间通过双桥基相连。下图为一种NbaXb的结构单元,试写出该物质的化学式:
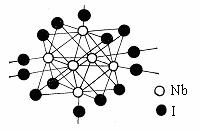 _____________________________________
_____________________________________
21.(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
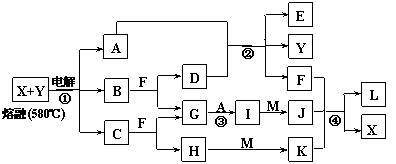 试回答下列有关问题:
试回答下列有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是 。
⑷反应④的离子反应方程式是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com