
题目列表(包括答案和解析)
25.(9分)有一种稀有气体化合物六氟铂酸氙XePtF6,研究报告指出:关于XePtF6的结构有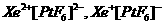 两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6:加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。试回答:
两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6:加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。试回答:
(1)XePtF6中各元素的化合价分别是__________________。
(2)XePtF6是__________(填“离子”或“共价”)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式:__________;而且O2与PtF6可发生类似的反应,其反应式是_______________。上述两反应属______________。
a. 均为氧化还原反应 b. 前者是氧化还原反应,后者是非氧化还原反应
c. 均为非氧化还原反应
24.(6分)在世纪交际之时,罗马尼亚国炼金废水泄入多瑙河,导致大量鱼类等水生物死亡,沿河居民已长期停止使用此水源,酿成世界级污染事件。炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)剧毒物HCN的结构式为__________,其水溶液酸性很弱,可知NaCN溶液pH______7(填“>”“=”或“<”)。
(2)与弱电解质碳酸的电离方程式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式是______________。
(3)处理这种废水时,是在碱性条件下用NaClO将CN-氧化为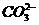 和N2,其离子方程式为________________。
和N2,其离子方程式为________________。
23.(20分)用废铁屑与稀硫酸反应,可制得硫酸亚铁。在10℃和50℃时,FeSO4在100g水中的溶解度分别为20.5g和48.6g。常温下,从溶液析出的晶体是FeSO4·7H2O。现取200mL 0.500mol/L H2SO4溶液,将8.00g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约15min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是__________。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的pH
(2)反应15min后过滤,其目的是___________________。
(3)滤液中除FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是____。它是由_________而产生的,其检测的方法是_______________。
(4)设H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至50℃时,溶液的体积约为50.0mL,该溶液是否达饱和?试通过计算加以说明。(50℃时,FeSO4饱和溶液的密度为1.36g/cm3)
(5)若要计算在80℃下将溶液蒸发至体积为70.0mL,再冷却至10℃时,所得到的FeSO4·7H2O的质量,你认为_________(填编号)。
A.前面提供的数据已经足够
B.还需要提供10℃时饱和溶液的密度:1.42g/cm3
C.还需要提供80℃时溶液的密度:1.30g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0mL
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从80℃50.0mL溶液冷却至10℃时结晶析出的FeSO4·7H2O的质量。(计算结果保留3位有效数字)
22. (11分)随着科学技术的发展,阿伏加德罗常数测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(11分)随着科学技术的发展,阿伏加德罗常数测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mg NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步聚(1)中A仪器最好用________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,_______;理由是__________。
③能否用胶头滴管代替步骤(2)中的滴定管;理由是____________________。
④能否用水代替苯________;理由是_____________________________________。
⑤已知NaCl晶体的结构如图所示,用X射线测得NaCl晶体靠得最近的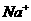 与
与 间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数NA的表达式为NA=_______________。
间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数NA的表达式为NA=_______________。
21.(4分)现有下列仪器和用品:①托盘天平 ②玻璃棒 ③烧杯 ④量筒 ⑤铁架台
⑥铁圈 ⑦滤纸 ⑧胶头滴管,进行过滤操作需用以上仪器和用品中的_______,还缺少的仪器是________;若要用NaOH固体配制0.5mol/L NaOH溶液一定要用到的仪器有__________,还需增加的玻璃仪器是_____________。
20.固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟该原子同周期的稀有气体原子一样,则下列说法中,不正确的是
A.1molNH5中有5NA个N-H键(NA为阿伏加德罗常数)
B.NH5中既有共价键,又有离子键,是离子晶体
C.NH5跟水反应是氧化还原反应
D.NH5跟水反应的化学方程式为: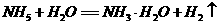
19.科学家发现铂的两种化合物a和b。
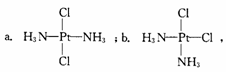
实验测得a和b具有不同的特性。A具
有抗癌作用,而b没有,则下列关于a、b的叙述正确的是
A.a和b属于同一种物质 B.a和b互为同分异构体
C.a和b的空间构型是平面四边形 D.a和b的空间构型是四面体
18.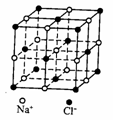 用NA表示阿伏加德罗常数,下列说法正确的是
用NA表示阿伏加德罗常数,下列说法正确的是
A.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.23.4gNaCl晶体中含有0.1NA个如图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
17.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为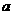 ,则B元素原子序数为
,则B元素原子序数为
A.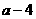 B.
B.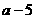 C.
C.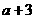 D.
D.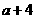
16.下列关于氢原子电子云图的说法中正确的是
A.黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.电子云图是对电子运动无规律性的描述
D.电子云图是用统计方法描述电子运动的结果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com