
题目列表(包括答案和解析)
6、100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
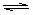 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
5、2005年10月12日我国成功发射了第二艘载人航天飞船--“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
4、已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3- C.MnO4- D.HNO3
3、下列有关物质的结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英、食盐、金属钠、干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
2、不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
1、能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一。背景材料:①2005国际油价飙升,新型纳米金属燃料面世;②2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③到2010年,江苏省将打造成为全国最重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯。下列说法正确的是
A.乙醇汽油的推广使用大大了降低国际市场的油料价格
B.生物柴油燃烧不会产生二氧化碳,是一种清洁能源
C.太阳能是一种清洁安全的不可再生能源
D.纳米金属燃料表面积大,易引发,能量释放快
29.(8分)某核素R具有微弱放射性,其原子核内中子数比质子数多43。由它组成的固体单质A,在一定条件下密度为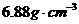 。用X射线研究其固体表明:在边长为
。用X射线研究其固体表明:在边长为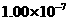 cm的立方体中含有20个原子。R在化学反应中常表现为
cm的立方体中含有20个原子。R在化学反应中常表现为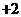 价、
价、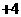 价,在溶液中
价,在溶液中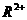 稳定,而
稳定,而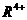 具有强氧化性,可将NO氧化为HNO3。氧化物R3O4的性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿的环境中易形成铁锈。R的单质及化合物在工业生产、医疗卫生、科学技术等各个领域都有很多用途,请回答:
具有强氧化性,可将NO氧化为HNO3。氧化物R3O4的性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿的环境中易形成铁锈。R的单质及化合物在工业生产、医疗卫生、科学技术等各个领域都有很多用途,请回答:
(1)R原子的摩尔质量为______________。
(2)R元素处于周期表中第_________周期_________族。
(3)使少量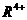 加到FeCl2溶液中,会发生反应,其离子方程式为________________。
加到FeCl2溶液中,会发生反应,其离子方程式为________________。
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。R3O4与定量的HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质。此反应的方程式为____________________________________。
28.(8分)现代原子结构理论主为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5……个轨道。试根据电子填入轨道的顺序预测:
(1)第8周期共有____________种元素;
(2)原子核外出现第一个6f电子的元素的原子序数是________。
(3)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于_________周期,_________族元素,原子的外围电子构型是__________。
27.(8分)元素的原子在分子中吸引电子的能力可以用电负性x 表示。下表是某些短周期元素的x值:
|
元素符号 |
x值 |
元素符号 |
x值 |
|
Li |
0.98 |
Be |
1.57 |
|
B |
2.04 |
C |
2.55 |
|
N |
3.04 |
O |
3.44 |
|
F |
3.98 |
Na |
0.93 |
|
Mg |
1.31 |
Al |
1.61 |
|
P |
2.19 |
S |
2.58 |
(1)根据表中数据归纳元素的电负性与原子吸引电子的能力的关系_________。
(2)试推测,周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为___________。
(3)若NCl3最初水解产物是NH3和HClO,则x(Cl)的最小范围:_____<x(Cl)<____(填表中数值);若已知x(P)<x(Cl),则PCl3水解的化学反应方程式是_______。
26.(6分)W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1, Y原子最外层s电子与p电子数之比为1∶1, Z原子核外电子中p电子数比Y原子多2个。
(1)W元素的单质与H2O反应离子方程式_________________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为________<_______(用分子式表示)。这四种元素原子半径的大小为_____>_____>_____>____(填元素符号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com