
题目列表(包括答案和解析)
1.同主族两种元素原子的核外电子总数的差值不可能为
A.8 B.16 C.30 D.44
25.(14分)由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x。将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持1.01×105Pa,120℃收集所得气体,冷却、称量,真空管中固体质量增加y g。
(1)若a=1,则y=________ ____(用含x代数式表示)。
(2)若a=2,x=0.3时,y=_____________。
(3)若a=2,试讨论:x取值不同时,反应后所得气体成份及y的表达式(不一定填满)。
|
x的取值范围 |
反应后所得气体成份 |
y的表达式 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
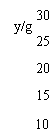 (4)若a=1.25,试作图表示y与x的关系(关键点要标明数据)。
(4)若a=1.25,试作图表示y与x的关系(关键点要标明数据)。
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
24.(11分)将25.6g Cu投入50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是 。
(2)判断25.6g Cu和50mL 12mol/L的硝酸反应后何者有剩余? 。其物质的量是 。
(3)如果4.48L(标准状况)NO和NO2的混合气体是通过排水法进行收集,则收集到的气体的体积(标准状况)是 。
(4)如果往反应后的体系内再加入200mL 4mol/L的稀硫酸,又有气体逸出,写出离子反应方程式,并计算新产生气体的体积(标准状态)。
23.(9分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ____________ mol·L-1 c(H+) - c(MOH) = _______________ mol·L-1
22. (8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
|
原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶2 |
⑴元素D在元素周期中的位置 。
⑵B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为 ;X的熔点 金刚石(填“大于”、“等于”或“小于”)。
⑶写出图I中沸点最高的单质与NaOH溶液反应的离子方程式 。
21.(12分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
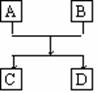 (1)若A、D的组成元素同主族:
(1)若A、D的组成元素同主族:
①B是水:__________________________________________。
②B、C均为氧化物(反应有重要的工业价值):
___________________________,工业价值是:_________________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:__________________________________________;
B是水且水是氧化剂(反应有重要的工业价值): 工业价值是:
②B、C均为氧化物且B不是水:____________________________________________。
20.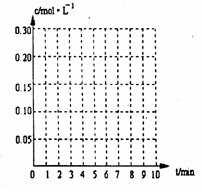 (8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=
a mol·L-1。
(8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=
a mol·L-1。
(1)0min-4min内生成O2平均速率v(O2)= mol·L-1·min-1;
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min-8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
19.(6分)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为 。在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为 ,从以上实验可知,ClO-、I2、SO42-的氧化性由强到弱的顺序是 。
18.(10分)某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在试管中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热试管至有较多量气体产生时停止加热,品红试液颜色褪去试管中溶液变为棕黄色。④一段时间后KMnO4/H+溶液颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体,试管中液体变为浅绿色。根据以上实验回答:
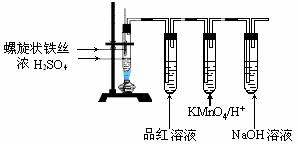
(1)在步骤②中现象说明 ;
(2)在步骤③中,品红褪色的原因是 ;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方程式表示) ; ;
(4)设计实验证明反应后的溶液中有Fe2+: 。
17.(4分)⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是 (填编号)。
①分馏石油时用的温度计 ②制备乙烯时用的温度计
③用水吸收溴化氢的导管口 ④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
⑵(4分)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com