
题目列表(包括答案和解析)
8.2.8gFe全部溶于一定浓度、100mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A.反应前HNO3溶液的浓度为2.0mol·L-1 B.1.12L的气体全部为NO
C.反应后溶液中c(NO3-)=1.6mol·L-1 D.反应后的溶液最多还能溶解1.61gFe
7.下列各项因果关系中正确的是
A.金刚石的熔点高于晶体硅,因为两种晶体中原子间平均距离前者小于后者
B.水的热稳定性比较高,因为水分子之间存在氢键
C.金属晶体能导电,因为金属晶体中存在金属阳离子
D.离子晶体硬度较大、难于压缩,因为离子晶体中的阴、阳离子排列很有规则
6.能证明CH3COOH为弱电解质的实验是
① 分别测定浓度均为0.1mol·L-1的HCl溶液和CH3COOH溶液的pH;② 分别向浓度均为1mol·L-1的HCl溶液和CH3COOH溶液中投入大小外观基本相同的Zn粒;③ 测定一定浓度的CH3COONa溶液的pH;④ 将1.0mol·L-1的HCl溶液和1.0mol·L-1的CH3COOH溶液分别稀释100倍,并分别测定两种溶液稀释前后的pH;⑤ 将等浓度盐酸和醋酸分别滴加到等浓度的Na2CO3溶液中。
A.除⑤外均可以 B.只有①和③ C.全部 D.只有②和⑤
5.下列各种情况下一定不能大量共存的离子组是
A.能与Al反应放出H2的溶液中:Na+、K+、CO32-、SO42-
B.0.1mol·L-1NaOH溶液中:NH4+、NO3-、Br-、HCO3-
C.能与Na2CO3反应放出CO2的溶液中:H+、Mg2+、Ba2+、I-
D.pH为1的紫色溶液中:K+、Fe2+、Cl-、MnO4-
4.设NA为阿伏加德罗常数,下列有关说法正确的是
A.标准状况下,22.4LSO3中含有的氧原子数为3NA
B.铜的电解精炼时,当阴极析出32gCu时,阳极产生的Cu2+离子数为0.5NA
C.将5.0mol·L-1的FeCl3溶液20mL滴加到沸水中形成的胶体中,分散质粒子数为0.1NA
D.26.75gNH4Cl中含有的共用电子对数为2NA
3.NaBH4含有BH4-离子(H为-1价)而具有极强的还原性。在金属和非金属底物材料上用NaBH4镀镍,可得到耐腐蚀、坚硬的保护层(3Ni3B+Ni),反应方程式为:
20NiCl2+16NaBH4+34NaOH+6H2O=2(3Ni3B+Ni)+10NaB(OH)4+40NaCl+35H2↑
关于该反应的说法不正确的是:
① B元素在反应前后化合价不变;② (3Ni3B+Ni)是还原产物,H2是氧化产物;③ 每生成1molH2时,转移的电子数为2mol;④ NaBH4的还原性强于H2;⑤ H2中的H元素来自于NaBH4和H2O;⑥ (3Ni3B+Ni)是一种化合物,化学式为Ni10B。
A.①②③⑥ B.①④⑤⑥ C.②③④⑥ D.②③⑤⑥
2.固体电解质又称离子导体,在一定温度范围里具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样以离子为导电载体。下列物质能作为固体电解质的是
A.铜 B.碳素钢 C.氯化钠晶体 D.干冰
1. 开发和和平利用核能是人类解决能源危机的一个重要途径。原子核在一定条件下发生裂变(fission)或聚变(fusion)能释放出大量的能量,这就是核能。下面是一个自发进行的核裂变过程:
开发和和平利用核能是人类解决能源危机的一个重要途径。原子核在一定条件下发生裂变(fission)或聚变(fusion)能释放出大量的能量,这就是核能。下面是一个自发进行的核裂变过程:
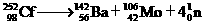 。下列有关说法正确的是
。下列有关说法正确的是
A.核裂变或聚变中化学能转变为核能 B.该核裂变遵循质量守恒定律
C.Ba是人工核反应制得的超铀元素 D.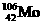 中含有106个中子
中含有106个中子
23.(6分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/L HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)产物中硝酸铜的物质的量______________mol;
(2)如混合物中含0.01molCu,则其中Cu2O的物质的量是________mol
(3)如混合物中Cu的物质的量为X,求X的取值范围。
22.(14分)为了证明实验室制备氯气的过程中会有水蒸气和氯化氢挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
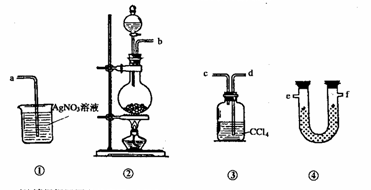
(1)请根据甲同学的意图,连接相应的装置,接口顺序为
(2)U型管中试剂的化学式为
(3)装置③的作用是
(4)乙同学认为甲同学的实验有缺陷,不能证明最终通入①装置的气体只有一种,他认为必须在①装置之前加入一个盛有 的洗气瓶,目的是
(5)丙同学也认为甲同学的实验有缺陷,但他认为无需加装置,只需把原烧杯中的溶液换成 ,他期望看到的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com