
题目列表(包括答案和解析)
5.在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2 vB =3 vA、
3 vC = 2vB,则此反应可表示为 ( )
A.2A + 3B = 2C B.A + 3B = 2C
C.3A + B = 2C D.A + B =C
4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
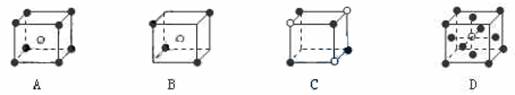
3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为 ( )
2.下列各原了或离子的电子排布式错误的是 ( )
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
1.遇有下列情况,及时处理有误的是 ( )
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C.金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
28.(11分)常温下在20mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶
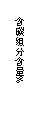
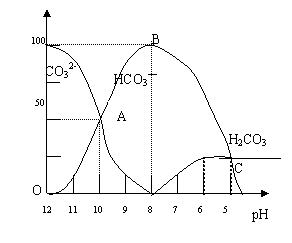 液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
化(CO2因逸出未画出),如下图所示:
回答下列问题:
(1)20 mL 0.1mol/LNa2CO3溶液呈碱性的
原因是(用离子方程式表示) ;
其溶液中所有阳离子和阴离子的浓度有何关系?
(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微
弱的,发生水解的CO32-离子不超过其总量的10%。
请你设计简单实验证明该同学的观点是否正确 。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则Ksp(X)= 。
(4)请写出OAB段的离子方程式 ;当混合液pH= 时,开始放出CO2气体。
27.(10分)
已知: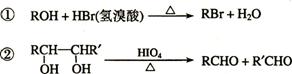
C、H、O三种元素组成的的有机物A,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。A中含有碳氧双键,与A相关的反应如下:
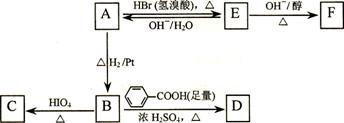
⑴.A的分子式为___________。
⑵A有2个不同的含氧官能团,其名称是 。.
⑶.写出E → F的反应类型: _______ ____。
⑷.写出C和F的结构简式:C ___________ 、 F ___________。
26.(12分) “卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),以它为原料,按如下工艺流程图,可制得“轻质氧化镁”。 如果要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定。
 |
|||||||
|
|||||||
|
|||||||
|
|||||||
|
 加E 煮沸
加E 煮沸

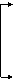
|
|
|
 加盐酸 加X 加Y
加盐酸 加X 加Y
|


 调节PH=9.8
调节PH=9.8
表一:生成氢氧化物沉淀的pH 表二:化学试剂价格表
|
物质 |
开始沉淀 |
沉淀完全 |
|
试剂 |
价格(元/吨) |
|
Fe(OH)3 |
2.7 |
3.7 |
漂液(含NaClO25.2%) |
450 |
|
|
Fe(OH)2 |
7.6 |
9.6 |
H2O2(30%) |
2400 |
|
|
Mn(OH)2 |
8.3 |
9.8 |
NaOH(固98%) |
2100 |
|
|
Mg(OH)2 |
9.6 |
11.1 |
Na2CO3(固95%) |
600 |
|
|
|
|
|
卤块(MgCl2,30%) |
310 |
(注)Fe(OH)2呈絮状,不易从溶液中除去,除Fe2+通常将它氧化成为Fe3+后,生成Fe(OH)3而除之。
请填写以下空白:
(1)在步骤②中加入的试剂X,最佳选择应是 简述原因:
;试剂X的作用是 。
(2)在步骤③中加入的试剂应是 ,控制pH=9.8的目的是
。
(3)有同学提出控制pH=9.6更为合适,你认为是否正确 (填正确、不正确)并说明理由: 。
25. (10分) 短周期元素A、B、C、D的原子序数依次递增,A、B、C其原子的最外层电子数之和为9。A与B、C、D位于相邻周期,C原子最外层电子数是A原子次外层电子数的2倍或者是B原子最外层电子数的4倍。化合物BD是一种重要的调味品。试解答下列有关问题:
(1)B在周期表中的位置:第 周期、第 族。
(2)A、C的单质以及它们之间反应生成的化合物在常温时状态相同,形成的晶体类型也相同,则晶体类型是 ;熔点由高到低的顺序为 (填元素符号或化学式)。
(3)工业生产B、D单质的原理是电解法。电解BD饱和溶液制取单质D的阳极反应式
为 ,电解熔融的BD制取单质B的化学方程式为 。
24.(8分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)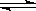 CH3OH(g) △H<0
CH3OH(g) △H<0
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.氢气的浓度减少 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com