
题目列表(包括答案和解析)
17.在0.1mol/L的Na2S溶液中,下列判断正确的是( )
A.c(OH-) = 2c(H2S)+ c(HS-)+ c(H+)
B.c(Na+)=2c(S2-)+ 2 c(HS-)+ 2 c(H2S)
C.c(Na+)>c(S2-)> c(HS-)> c(OH-)> c(H+)
D.c(Na+)+ c(H+)=c(S2-)+ c(HS-)+ c(OH-)
16、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是 ( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是 ( )
 A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是 ( )
A.反应开始时的速率:甲 = 乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙
D.反应结束时,pH值:甲<乙
14.已知在1×105Pa、298k条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A.H2O(g) = H2(g) +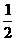 O2(g);△H = +242kJ·mol-1
O2(g);△H = +242kJ·mol-1
B.2H2 (g) + O2(g) + 2H2O (l);△H =-484kJ·mol-1
C.H2(g) +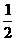 O2(g)
= H2O (g);△H = +242kJ·mol-1
O2(g)
= H2O (g);△H = +242kJ·mol-1
D.2H2 (g) + O2(g) = 2H2O (g);△H =-484kJ·mol-1
13. 可以充分说明反应P (g)
+ Q (g) R (g) + S
(g)在恒温下已达到平衡的是 ( )
可以充分说明反应P (g)
+ Q (g) R (g) + S
(g)在恒温下已达到平衡的是 ( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化 ( )
11.95年美国教授Lagow合成了一种链式炔碳:……-C≡C-C≡C-C≡C……。该物质的一个分子中含300~500个碳原子,性质很活泼。则下列说法错误的是: ( )
A.该物质的溶点比金刚石低
B.该物质可以使溴水褪色
C.该物质属于炔烃
D.该物质与金刚石互为同素异形体
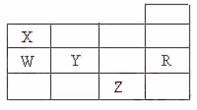 12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
12.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
10.在实验室里可按右图所示装置干燥收集气体R, 并吸收多余的R气,则R是( )
A.CH4 B.HCl 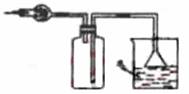
C.Cl2 D.NH3
9.某有机物的分子结构如下表示: CH ,该分子中最多可以有多少个原子共平面: ( )
A.19 B.20 C.21 D.22
7.实验室用乙醇和浓硫酸混合加热制得的乙烯气体中含少量SO2(记为混合气体①),碳与浓硫酸共热生成的气体中有CO2和SO2(记为混合气体②)。欲除去这两种混合气体中的SO2,下列说法正确的是 ( )
A.都可通过盛有酸性KMnO4溶液的洗气瓶
B.都可通过盛有NaOH溶液的洗气瓶
C.①可用酸性KMnO4溶液洗气,②可用NaOH溶液洗气
D.①可用NaOH溶液洗气,②可用酸性KMnO4溶液洗气
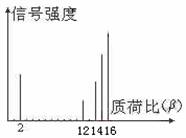 8.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-3g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H8离子化后可得到C2H6、C2H5、C2H4、……然后测定其质荷比β。设H+的质荷比为1,某有机物
8.2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-3g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H8离子化后可得到C2H6、C2H5、C2H4、……然后测定其质荷比β。设H+的质荷比为1,某有机物
样品的质荷比如下图(假设离子均带一个单位正电
荷,信号强度与该离子多少有关),则该有机物可
能是: ( )
A.CH3OH B.C3H8
 C.C2H4 D.CH4
C.C2H4 D.CH4
6.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
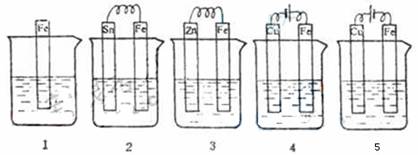
A.4>2>1>3>5 B.2>1>5>3>4
C.5>4>2>3>1 D.3>5>2>4>1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com