
题目列表(包括答案和解析)
10.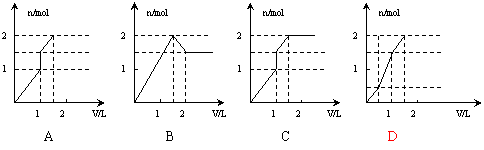 向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
9.有下列物质:酸:盐酸、硝酸、醋酸、稀硫酸;盐(包括正盐和酸式盐):钾盐、钠盐、钡 盐。在水溶液中相互混合反应,符合离子方程式:2H++SO32-=SO2↑t+H2O的化学反应的组合共有
A.10个 B.8个 C.6个 D.4个
8、下列离子方程式或化学方程式,正确的是
A、澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=CaCO3↓+H2O
B、氯化铁溶液中通入硫化氢气体: 2Fe3++3S2-=2FeS↓+S↓
C、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D、氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+=4NH4++AlO2-+2H2O
7.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数不可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
6、NA为阿伏加德罗常数,下列说法正确的是
A、1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA
B、常温常压下,32gO2-离子中所含电子的数目为17 NA
C、标准状况下,11.2 L四氯化碳所含分子数为0.5 NA
D、含有2NA个阴离子的Na2O2固体,投入足量水中产生约22.4L的氧气
5.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有
①:S(g)+O2(g)=SO2(g); ΔH=-Q1kJ/moL
S(s)+O2(g)=SO2(g); ΔH=-Q2kJ/moL
②:C(s)+1/2 O2(g)=CO(g); ΔH=-QlkJ/moL
C(s)+O2(g)=CO2(g); ΔH=-Q2kJ/moL
③:4Al(s)+3O2(g)=2Al2O3(s); ΔH=-QlkJ/moL
4Fe(s)+3O2(g)=2Fe2O3(s); ΔH=-Q2kJ/moL
④:2H2(g)+O2(g)=2H2O(g); ΔH=-QlkJ/moL
2H2(g)+O2(g)=2H2O(l); ΔH=-Q2kJ/moL
A.①② B.③④ C.②④ D.①③
4、下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀溶液共热 B、1molCu与含4molHNO3的浓硝酸
C、1molCu与含2molH2SO4的浓硫酸共热 D、1molMnO2与含4molHCl的浓盐酸共热
3、下列叙述中正确的是
A、CO2分子内含有极性键,所以CO2分子是极性分子
B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C、气态氢化物的稳定性:NH3>PH3>AsH3
D、某非金属元素从游离态变成化合态时,该元素一定被还原
2.下列各组物质的分类都正确的是(括号里的是类别)
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
1.下列有关叙述正确的是( )
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 赤潮、酸雨、臭氧层空洞、潮汐等都与环境污染有关
D. “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com