
题目列表(包括答案和解析)
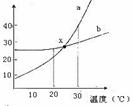
12. 如图是a、b两种固体物质的溶解度曲线,下列说法中错误的是( )
A.a中含有少量b时可以用结晶法提纯a
B.20℃时,a和b饱和溶液的物质的量浓度:a<b
C.30℃时,a和b饱和溶液的质量分数:a>b
D.x点表示的a和b溶液都是饱和溶液
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法不正确的是( )
A.电池工作时,电子由正极通过外电路流向负极
B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
 D.电池工作时,锌失去电子
D.电池工作时,锌失去电子
10.
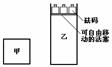 一定温度下,有可逆反应:2A(g)+2B(g)
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
|
|
关于两容器中反应的说法正确的是( )
A.甲容器中的反应先达到化学平衡状态
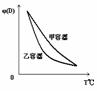
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体的平均相对分子质量也不相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
9. 某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是( )
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
8.6.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100g98%的浓硫酸中含氧原子个数为4NA
B.1mol 苯分子中含有碳碳双键数约为3×6.20×1023
C.标准状况下,22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
D.60gSiO2晶体中含SiO2分子数约为6.02×1023
7.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
6.下列有关叙述正确的是( )
 A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的强
29. (15分)电子工业常用一定浓度的 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3 + Cu
= CuCl2 + 2FeCl2
溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3 + Cu
= CuCl2 + 2FeCl2
现将一块敷有铜箔的绝缘板浸入 某
某 溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入
溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入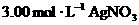 溶液60.00 mL时,溶液中的
溶液60.00 mL时,溶液中的 恰好完全沉淀.请计算:
恰好完全沉淀.请计算:
(1)溶液A中 的物质的量浓度为_________________
的物质的量浓度为_________________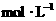 ;
;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于______________g;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
|
剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
|
|
|
有铁且有铜 |
|
(用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中 的物质的量浓度为________
的物质的量浓度为________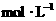 .
.
28.(15分)校办厂漂白车间需22.4 L(标准状况)SO2。化学小组同学依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回。
(1)化学小组所制得的气体中混有的主要杂质气体可能是___________(填分子式)。产生这种结果的主要原因是_________________________________________________________。
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收)。
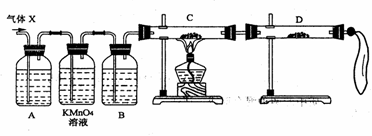
①组装好仪器后,盛放药品前,必要的一个操作是__________________________。
②A中加入的试剂可能是:___________,作用是:_____________________________。
B中加入的试剂可能是:_________________,作用是:________________________。
③可证实气体x中混有较多量某杂质气体的实验现象是:
C中:____________________________,D中:______________________________。
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为________________ (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
27.(15分)乳酸CH3-CH(OH)-COOH是人体生理活动的一种代谢产物,以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。
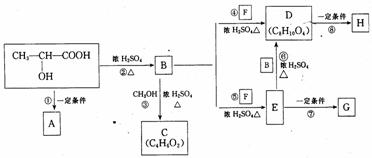
请回答下列问题:
(1)写出C、D的结构简式: C _____ _ D _ ___
(2)从下述三个有机基本反应类型中选择指出反应②③所属的类型(填代号):② ③
A.取代反应 B.加成反应 C.消去反应
(3)写出下列反应的化学方程式:
① _____ ___ ____ ⑤ ________ _______
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com