
题目列表(包括答案和解析)
8.在水电离出的c(H+)=10-13 mol/L的溶液中,一定不能大量共存的离子组是( )
A.K+、Fe3+、Cl-、NO3- B. Ba2+、Na+、Cl-、NO3-
C. Al3+、NH4+、SO42-、Cl- D. Na+、K+、HCO3-、SO42-
7.下列说法正确的是 ( )
A.有些物质是由分子直接构成,如二氧化碳、二氧化硫等;有些物质是由原子直接构成,如金刚石、重晶石等;有些物质是由离子直接构成的,如食盐、纯碱等
B.分子是保持物质性质的一种微粒,也是化学变化中的最小微粒
C.N2O5 、N2O3、NO2不都是酸性氧化物;Na2O、Na2O2、Al2O3不都是碱性氧化物
D.H2O 是一种非常稳定的化合物,这是由于氢键所致
6.已知在一绝热容器中,饱和石灰水中存在平衡:Ca(OH)2(s) Ca2++2OH-,现向其中加入少量生石灰,则下列说法错误的是 ( )
Ca2++2OH-,现向其中加入少量生石灰,则下列说法错误的是 ( )
A.析出固体的质量增加 B.溶液中Ca2+的浓度减小
C.溶液中OH-数目减少 D.溶液的pH值不变
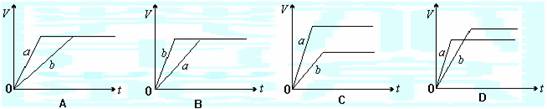
5.在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g)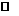 C (g)+D(g)
已达到平衡状态的是 ( )
C (g)+D(g)
已达到平衡状态的是 ( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,
⑤混合气体的平均相对分子质量,⑥v(C)与v(D)的比值
A.②③⑤ B.①②③ C.②③④⑥ D.①③④⑤
4.等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,
 下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
3.下列离子反应方程式错误的是 ( )
A.过量的硫化氢通入NaOH溶液 H2S+OH-=HS-+H2O
B.向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.向100mL 0.1mol/L 的FeBr2溶液中通入0.025mol的Cl2
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入过量石灰水
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
2.下列物质中,属于含有极性键的离子晶体是 ( )
A.CH3COOH B.Na2O2 C.NaOH D.MgCl2
1.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是 ( )
A.该元素属于第七周期 B.该元素位于III A族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含有114个电子和184个中子
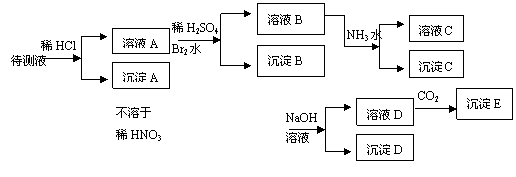
32.(12分)某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子,进行如下实验(所加酸、碱、氨水、溴水CO2都是过量的)。
|
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子: 。理由是: 。
(2)写出沉淀D的分子式: 。
(3)写出从溶液D生成沉淀E的反应的离子方程式: 。
(4)写出从溶液B生成沉淀C的反应的离子方程式: 。
31.(10分)回答下列问题(不要求写出计算过程,)
(1)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224ml CO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。请写出:CNG的化学式 ,其完全燃烧的热化学方程式
。
(2)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则生成1molNH3的反应热为 。
(3)已知:H2O(g)=H2O(l) △H=Q1KJ/mol
C2H5OH(g)=C2H5OH(l) △H=Q2KJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=Q3KJ/mol;则23g酒精液体完全燃烧的反应热为 。(最后恢复到室温)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com