
题目列表(包括答案和解析)
11.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是
A.10% B.25% C.30% D.35%
10.下列有关叙述正确的是
A.铁在点燃或灼热的条件下能与氯气反应生成氯化物,所以不能用钢瓶来储运液氯
B.电解质的导电性和金属晶体的导电性都随温度的升高而降低
C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
D.碱金属单质性质活泼,易和O2、H2O反应,所以通常都保存在煤油中
9.下列各组离子在溶液中能大量共存的是
A.Fe3+、SCN-、Na+、SO42- B.NH4+、Na+、HCO3-、NO3-
C.Mg2+、H+、I-、NO3- D.Na+、Al3+、S2-、Cl-
8.有以下七种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(clO)2:④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaC1,分别持续通入CO2,最终能得到沉淀或析出晶体的是
A.②④⑥ B.①⑨⑥ C.⑤⑥⑦ D.②③⑥
7.在下列各说法中,正确的是
A.热化学方程式中的化学计量数表示物质的量,所以可以是分数
B.△H>0kJ·mol-1表示放热反应,△H<0kJ·mol-1表示吸热反应
C.1 molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
6.有下列物质:酸:盐酸、硝酸、醋酸、稀硫酸;盐(包括正盐和酸式盐):钾盐、钠盐、钡 盐。在水溶液中相互混合反应,符合离子方程式:2H++SO32-=SO2↑t+H2O的化学反应的组合共有
A.10个 B.8个 C.6个 D.4个
5.取ng某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ng。下列物质中不能满足上述结果的是
A.H2和CO的混合气 B.甲醇
C.苯甲醛 D葡萄糖
4.用NA表示阿伏加德罗常数的值,下列说法中不正确的是
A.23g Na和O2恰好完全反应,一定失去NA个电子
B.1moL的KClO3与足量的浓盐酸反应,得到的电子数为5NA
C.含有2NA个阴离子的Na2O2固体,投入足量水中在标况下,能产生约22.4L的氧气
D.标准状况下,2.24L氧单质所含原子数一定为0.2NA
3.铝、铍(Be)及其化合物具有相似的物理、化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断中不正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.Be(OH)2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.虽然BgCl2的水溶液导电性强,但熔融态的BeCl2却不能被电解
2.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有
①:S(g)+O2(g)=SO2(g); ΔH=-Q1kJ/moL
S(s)+O2(g)=SO2(g); ΔH=-Q2kJ/moL
②:C(s)+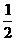 O2(g)=CO(g); ΔH=-QlkJ/moL
O2(g)=CO(g); ΔH=-QlkJ/moL
C(s)+O2(g)=CO2(g); ΔH=-Q2kJ/moL
③:4Al(s)+3O2(g)=2Al2O3(s); ΔH=-QlkJ/moL
4Fe(s)+3O2(g)=2Fe2O3(s); ΔH=-Q2kJ/moL
④:2H2(g)+O2(g)=2H2O(g); ΔH=-QlkJ/moL
2H2(g)+O2(g)=2H2O(l); ΔH=-Q2kJ/moL
A.①② B.③④ C.②④ D.①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com