
题目列表(包括答案和解析)
5.3g镁、铝合金与100mL稀硫酸恰好完全反应,将反应后所得溶液蒸干,得到无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为
A.1 mol/L B.1.5 mol/L C.2mol/L D.2.5mol/L
4.在一定条件下,合成氨反应达到平衡后,混合气体中氨气的体积分数为0.25。若反应前后条件不变,则反应后缩小的气体体积与原反应物的体积比值是
A.1/5 B.1/4 C.1/3 D.1/2
3.将3.20gCu跟30.0mL10.0mol/L的硝酸反应,产物只有NO和NO2。若反应后溶液中有a mol H+,则此时溶液中含有NO3-离子的物质的量为
A.a/2 mol B.2a mol C.0.1a mol D.(a+0.1) mol
2.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
1.密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直到沉淀完全为止,已知沉淀的质量与原硫酸溶液相等,则原硫酸溶液的浓度为
A.29.6% B.42.1% C.14.8mol/L D.6.22mol/L
24. (10分)有如下化学反应:2A(g)+B(g)
2C(g)(△H<0=
(10分)有如下化学反应:2A(g)+B(g)
2C(g)(△H<0=
(1)若将4mol气体A和2mol气体B在2L密闭容器中混合,经2s后测得C的浓度为0.6mol·L-1。则2秒时B的浓度为 mol·L-1。
(2)若把amol气体A和b mol气体B充入上述密闭容器,达到平衡时,它们的物质的量满足n(A)+n(B)=n(C),则气体A的转化率为 。
(3)如下图所示,将4mol气体A和2mol气体B混合后置于体积可变的等压容器中,一定温度下达到平衡状态X时,测得气体总物质的量为4.2mol。若A、B、C起始的物质的量分别用a、b、c表示,试回答:
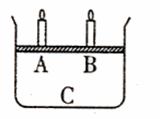
ⅰ:达到平衡状态X时的容器中,通入少量B气体,容器中A的体积分数 (填“增大”、“减小”或“不变”)。若要使A的体积分数再升高到与平衡状态X相同,可采取的一种措施是 (只填一种即可)。
ⅱ:若起始a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态X相同,则起始时C的取值范围为 。
23. (10分)已知:Ⅰ.CH3COONa+NaOH
CH4↑+Na2CO3
(10分)已知:Ⅰ.CH3COONa+NaOH
CH4↑+Na2CO3
|
 Ⅱ.R-CH==CH2+H2O
RCH2CH2OH
Ⅱ.R-CH==CH2+H2O
RCH2CH2OH
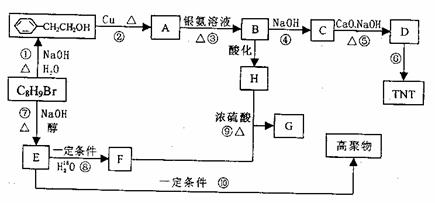 现有分子式C8H9Br的有机物在一定条件下能发生下图所示的一系列反应:
现有分子式C8H9Br的有机物在一定条件下能发生下图所示的一系列反应:
请回答下列问题:
(1)写出C8H9Br的结构简式: 。
(2)上述反应中属于消去反应的有(填编号) 反应。
(3)写出反应⑥、⑨的化学方程式:
反应⑥:
反应⑨:
(4)写出H可能有的3种同分异构体(要求:a.苯环上只有一个取代基,b.3种异构体不同类别):
22.(16分)某无色溶液中可能存在的离子如下: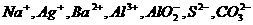
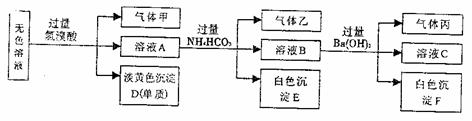
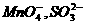 。取10mL该溶液进行实验,有关实验过程、现象及产物如下图所示:
。取10mL该溶液进行实验,有关实验过程、现象及产物如下图所示:
回答下列问题:
(1)沉淀D是(填名称) ,生成该沉淀的离子方程式为:
;
生成气体乙的离子方程式为: ;
生成沉淀F的离子方程式为: ;
(2)若测知气体甲为两种成分,则气体和原溶液中溶质的可能组成为(将结果填入下表中。)
|
可能情况 |
(1) |
(2) |
|
气体可能 组成 |
|
|
|
溶质可能组成 (填化学式) |
|
|
(3)若测知气体甲的成分只有一种时,则原溶液中一定存在的离子有 ,可能存在的离子有 。
|
21.(12分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。
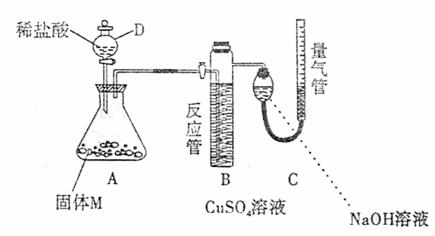
根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是 。
(2)固体M中一定有的物质是 (写化学式)。
(3)写出A中发生反应的化学方程式(只写一个):
。
(4)写出B中析出黑色沉淀时发生反应的离子方程式 。
(5)根据题给条件,固体M中一种物质的质量可以确定,应为 g(用代数式表示)。
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是 (写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是 。
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为: 。
A.KSCN溶液 B.NaOH溶液 C.氨水
20.(14分)简要回答下列问题:
(1)春夏季下雨时常伴有“电闪雷鸣”现象,因“闪电”而发生的化学反应有(举两例,用化学方程式表示):
①
②
(2)酸雨的pH小于5.6,放置一段时间后pH还会减少。其原因是(用化学方程式表示):
(3)铁的纯度越高越不易生锈;钢铁表面上若附着有电解质更易生锈。铁锈的化学成分是:Fe2O3·nH2O。请写出钢铁生锈时有关反应的化学方程式(包括电极反应及其总反应):
电极反应式:
总反应式:
其它反应:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com