
题目列表(包括答案和解析)
3.吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如 O 等,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是
A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.以上均不是
2.在电解水制取H2和O2时,为了增强导电性常常要加入一些电解质,下列物质不宜选用的是( )
A.NaOH B.H2SO4 C.NaCl D.Na2SO4
1.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.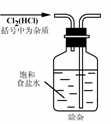 B.
B.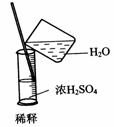
C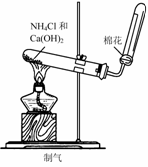 D.
D.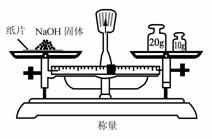
29.(15分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·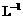 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 _ ,
产物中的单质B是____________。
(2)②中所发生的各反应的化学方程式是________________________________________________
(3)③中所发生的各反应的离子方程式是_________________________________________________
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,
c(Fe2+)为_________________。
28、.(15分)
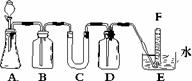
在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选用适当的化学试剂和实验用品、用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
A是制取CO2;的装置。写出A中发生反应的化学方程式:
(2)填写表中空格:(请在答题卡上填空)
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式:
(4)试管F中收集满气体后,下一步实验操作是:
27、(15分)硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸猴,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 ___ ________________________________________________________。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
26.(15分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是
(2)实验步骤②明显不合理,理由是 。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是
。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为 。
13.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电
一段时间后,析出钾、镁、铝的物质的量之比为
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
第Ⅱ卷
12.下列实验操做或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀硫酸清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C.不慎将浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.在250ml烧杯中,加入216ml水和24g氢氧化钠固体,配制10%NaOH溶液
11..NA代表阿伏加德罗常数,下列说法正确的是
A.0.5 mol Al与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2 L SO3所含的分子数为0.5NA
C. 0.5 mol CH4所含的电子数为1NA
D.46 g NO2和N2O4的混合物含有的原子数为3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com