
题目列表(包括答案和解析)
1.下列有关环境、健康、发展的叙述中,不正确的是:
A.可吸入颗粒(例如硅酸盐粉尘)在空气中形成气溶胶,对人类健康危害极大。
B.开发利用新能源,合理利用工业生产的废热,是缓解能源危机的重要途径。
C.氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物。所以它们的含量是空气质量报告的主要项目之一。
D.用二氧化硫漂白的食物白皙鲜嫩,且能防腐,但二氧化硫不可作食品添加剂。
22. (12分) Cl2通入70℃的NaOH水溶液中,发生氧化还原反应,反应完成后,测得溶液中NaClO和NaClO3的物质的量之比为4:1,则①配平溶液中所发生反应化学方程式





 Cl2 + NaOH = NaCl
+ NaClO3+ NaClO + ______
Cl2 + NaOH = NaCl
+ NaClO3+ NaClO + ______
②反应中的氧化剂是__________________,氧化产物_____________________;
③此反应的离子方程式为_____________________________________________
④已知生成0.1molNaClO,反应中转移的电子数是__________mol,若溶液的体积正好是100ml,则溶液中NaCl的物质的量浓度为_______________mol/L。
嵩明一中高三化学第二次月考
21.(12分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

已知:沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O NaHCO3↓+NH4Cl
(1)写出煅烧炉中发生反应的化学方程式
(2)该实验得到的纯碱中含有氯化钠。甲同学设计的测定样品纯碱含量的方法如图Ⅰ,试回答:
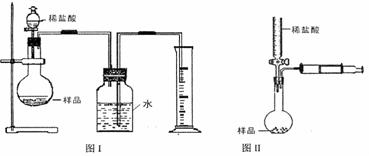
①写出烧瓶中发生反应的离子方程式
②该设计方案会造成误差,其原因可能为(写两种即可)
、
③若读取量筒中水的体积时俯视,由此会造成实验结果 (填偏高、偏低或不影响)。
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试回答:
①检查该装置气密性的方法为:
②设滴定管的起始读数为a mL,终了读数为b mL,注射器测定排出的气体为c mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数表达式为 (用含a、b、c、m的代数式表示)。
20.(6分) 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是_________,一定不含的物质是_________________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出②步变化的离子方程式。
19.(4分)一个体重50 kg的健康人含铁元素2 g。这2 g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为: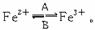 在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
在过程A中,Fe2+作_________剂;过程B中,Fe3+被_________。
(2)“服用Vc可使食物中的Fe3+转化为Fe2+”这句话指出,Vc在这一反应中作_________,具有_________性。
18.(6分)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为: 。
在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为:
。
从以上事实可知,ClO-、I2、SO42-的氧化性由强到弱的顺序是 。
17.(12分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
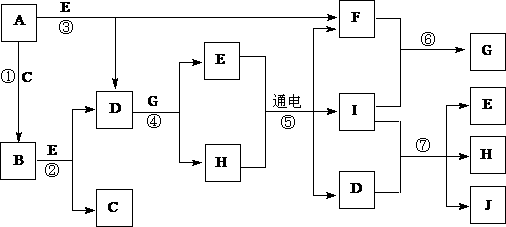
(1)写出反应⑤的化学方程式:_________________________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色。
16.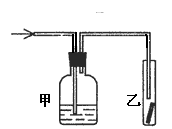 将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水
A.①② B.②③
C.①②③ D.①②③④
第II卷(非选择题 共52分)
15.将过量的CO2分别通入:①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液 ⑤NaAlO2溶液。最终有沉淀生成的是 ( )
A、②④⑤ B、②③⑤ C、②⑤ D、①②③④⑤
14.下列物质性质递变规律正确的是
A.酸性HFO4>HClO4>HBrO4>HIO4 B.稳定性HF>HCl>HBr>HI
C.酸性:HF>HCl>HBr>HI D.还原性:I->Br->Cl->S2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com