
题目列表(包括答案和解析)
4.作为微生物氮源的营养物质中最常用的是 ( )
A.分子态氮和氨 B.铵盐和硝酸盐
C.尿素和胺 D.牛肉膏和蛋白胨
3.原核细胞基因的非编码区组成是 ( ) A.基因的全部碱基序列组成 B.信使RNA上的密码序列组成 C.编码区上游和编码区下游的DNA序列组成 D.能转录相应信使RNA的DNA序列组成
2.人体内胰岛素、性激素的化学成分是 ( )
A. 都是蛋白质 B.前者是蛋白质,后者是固醇
C. 都是固醇 D.前者是固醇,后者是蛋白质
1.人体细胞中核酸的核苷酸种类数以及碱基种类数分别是 ( )
A. 4 , 5 B.5 , 8 C.8 , 4 D.8 , 5
25.(10分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:
2NO2 + 2NaOH === NaNO3 + NaNO2 + H2O
NO + NO2 + 2NaOH === 2NaNO2 + H2O;
⑴若在标准状况下有NO、NO2的混合物恰好与50mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
⑵设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为 。(写出解题过程)
⑶根据⑵的计算结果,在以下坐标系中作出其示意图。
24.(8分) 工业上用含硫质量分数为m%的硫铁矿(主要成分为FeS2)通过接触法制硫酸,反应过程中S 的转化率为n%。问a t此硫铁矿理论上能制得 t 98%的浓硫酸。若该浓硫酸完全用于工业上制胆矾,写出其反应的化学方程式 , 。
其理论产量为 t。
23.(10分) 将2molSO2和1molO2混合置于一定体积、压强的密闭容器中,在一定温度下发生如下反应:
2SO2(g)+O2(g)  2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
2SO3(g),△H < 0,当反应进行到时间t1点时达到平衡状态,测得混合气体总
物质的量为2.1 mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为 。
(2)保持压强恒定,体积可变:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量将 2.1mol(填“<”、“>”或“=”),
(3)保持恒温恒容的条件下:
若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);若在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,重新达到平衡状态时,SO2的转化率将(填“增大”、“减小”或“不变”)。
22.(8分)I. 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有_a 、c _(答案可能不止一个,填字母)。
a.离子键 b.极性共价键 c.非极性共价键
(2)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有
关反应的化学方程式 ____ 。
Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原
子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下
均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
⑴仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的
离子方程式为_ 。
⑵这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),该化合物的
水溶液与足量的NaOH溶液反应的离子方程式为: 。
21.(10分)《2004年江苏省环境状况公报》中指出:江苏省2004年工业(主要是热电厂)二氧化硫排
放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为
主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-
和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴江苏省大气污染特征是________________
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵请你提出江苏省防治酸雨的两条主要措施
_______________________________________________________________________;
_______________________________________________________________________。
⑶某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是(至少三种不同类型)________________________________________________________________________。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________________________________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
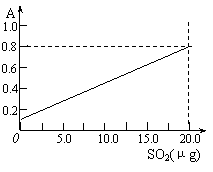 HCHO+H2SO3→
HCHO+H2SO3→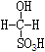 该反应类型属于__________。
该反应类型属于__________。
测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如右图所示。若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为
_____ __ ____,________ __________,_______ __________。
20. (10分) A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色, C的盐溶液通常为蓝色。它们之间有如下转化关系(其中反应③④⑦的产物中还有水):
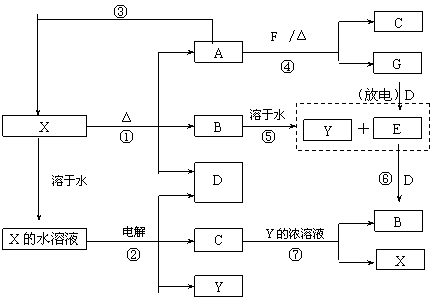
请回答下列问题:
⑴写出G分子的电子式: ;
⑵写出反应⑦的离子方程式是: ;
⑶写出电解X溶液的阳极反应式: ;
⑷写出反应④的化学方程式并标出电子转移情况: ;
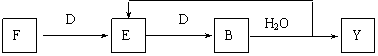 ⑸若使F按下列途径完全转化为Y:
⑸若使F按下列途径完全转化为Y:
则参加反应的F与整个过程中消耗D的物质的量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com