
题目列表(包括答案和解析)
7.t℃时,将溶质质量分数为a %的NaOH溶液蒸发掉m g水后恢复至原温度,恰好得到质量分数为2a %的NaOH饱和溶液V mL,则下列说法中正确的是
A.t℃时NaOH的溶解度为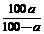 g
g
B.原溶液的质量为2m g
C.原溶液的物质的量浓度为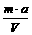 mol·L-1
mol·L-1
D.保持t℃,向原溶液中加入2a gNaOH可达饱和
6.下列各装置中都盛有0.1 mol·L-1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是
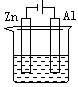
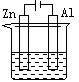
① ② ③ ④
A.③①④② B.①②④③ C.①②③④ D.②①④③
5.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶4 C.1∶9 D.2∶9
4.下列有关说法正确的是
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气
B.微粒半径由大到小顺序是:H>Li+>H+
C.水是一种非常稳定的化合物,这是由于氢键所致
D.CO2、CF4、PCl5四种物质分子中的所有原子都满足最外层为8电子的稳定结构
3.下列说法或表示方法中,正确的是
A.氧化还原反应一定都是放热反应
B.由C(金刚石)→ C(石墨):△H= -119 kJ/mol可知,金刚石较石墨稳定
C.在稀溶液中,H+(aq) + OH一(aq) = H2O(1);△H= -57.3KJ/mol。若将含0.5mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa 25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g) + O2(g) == 2H2O(1);△H = -285.8 kJ/mol
2.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
1.最近,美国国家实验室的两位科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是
A.CO2的原子晶体和CO2的分子晶体互为同素异形体
B.在一定条件下,CO2的原子晶体转化为CO2的分子晶体是物理变化
C.CO2的原子晶体和CO2的分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子跟两个C原子相结合
33.(8分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入pH=0的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
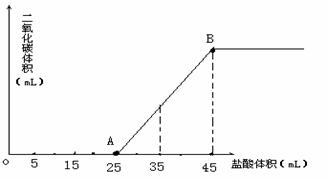
(1)写出OA段所发生反应的离子方程式。
(2)当加入35mL盐酸时,产生二氧化碳的体积 为 _ _____mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。
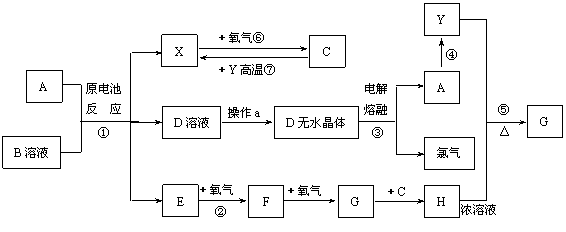
32.(12分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
(6)写出③反应的化学方程式
31.(10分)
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
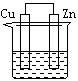
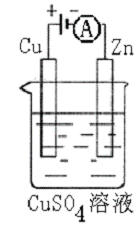
(3)右下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变 化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com