
题目列表(包括答案和解析)
17.(8分)⑴下列实验操作或对实验事实的叙述正确的是_____ CD________(填序号)
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
c.在硫酸铜晶体结晶水测定实验中,连续两次称量加热、冷却后硫酸铜的质量差不超过0.1g,即可认为晶体中结晶水以全部失去
d.在硫酸铜晶体结晶水测定实验中,将加热后硫酸铜放在空气中自然冷却后再称量(其它各步操作均正确),会使测量结果将偏低
e.在中和热测定的实验中,实验要重复2~3次,取测量所得数据的中间值作为计算依据。
⑵某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
① 实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 KOH溶液
稀H2SO4 溶液 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 1:4 。
16.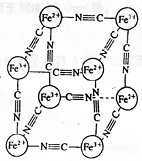 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN 位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是
位于立方体的棱上。其晶体中的阴离子晶胞结构如图示,下列说法不正确的是
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为M1Fe2(CN)6,且M为+1价
15.研究发现CuSO4和FeS2在一定条件下可发生如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 下列说法正确的是
A.FeS2中的硫元素全部被氧化
B.5molFeS2发生反应,有10mol电子转移
C.产物中SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
14.某学生设计了如图的方法对A盐进行鉴定:
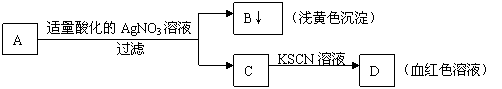
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
13.已知:⑴胆矾失水的热化学反应方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
⑵室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)= Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
⑶胆矾(CuSO4·5H2O)溶于水时,溶液温度降低。
则Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
12.蓄电池在放电时起原电池作用,在充电时起电解池作用,
下列是爱迪生蓄电池分别在充电和放电时的反应:Fe +NiO2+2H2O放电充电Fe(OH)2+ Ni(OH)2,下列有关爱迪生蓄电池的推断中不正确的是
A.放电时Fe作负极,NiO2作正极
B.放电时电解质溶液中的阳离子向正极移动
C.充电时的阳极反应是Fe(OH)2 +2e- == Fe + 2OH-
D.该蓄电池既可用KOH溶液又可用稀H2SO4作电解质溶液
11.下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
B.向硅酸钠溶液中通入过量的CO2: SiO32- + 2CO2 + 2H2O = H2SiO3↓+ 2HCO3-
C.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2+ + 2OH- + NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
10. 用石墨做电极电解3mol/LNaCl和0.5mol/LAl2(SO4)3混合溶液时,下列曲线合理的是
用石墨做电极电解3mol/LNaCl和0.5mol/LAl2(SO4)3混合溶液时,下列曲线合理的是
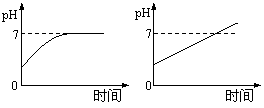


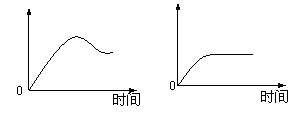
A B C D
9.NA代表阿伏加德罗常数,下列说法正确的是
A.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于1 NA
B.工业上电解精炼铜时每转移1mol电子时,阳极上溶解的铜原子数为0.5NA
C.1mol SiO2晶体中含有Si-O键为4NA,1mol晶体硅中含有Si-Si键为1 NA
D.7.1g C12与足量NaOH溶液反应转移的电子数为0.1NA
8.下列各组离子一定能在指定溶液中大量共存的是
A.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
B.水电离H+浓度为1×10-12mol/L的溶液中: Na+、K+、NO3-,Cl-,SO42-
C.使甲基橙变红的溶液中Fe2+、Al3+、NO3-、I-、Cl-
D.加入铝能放出氢气的溶液中: Na+、K+、Cl-、CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com