
题目列表(包括答案和解析)
2.某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为血红色,则下列叙述正确的是:( )
① 原溶液中的Br-一定被氧化
② 通入氯气后原溶液中的Fe2+一定被氧化
③ 不能确定通入氯气后的溶液中是否存在Fe2+
④ 若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
1.通过分析周期表结构和各元素性质的变化趋势,判断砹(原子序数为85)及其化合物的叙述正确的是( )
A.由KAt的水溶液制备At的化学方程式为2KAt + Cl2 == 2KCl +At2
B.相同条件下,HAt比HI难分解
C.AgAt是一种易溶于水的固体
D.At在第五周期VIIA族
25. (10分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(10分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入100mL 0.6mol/LHNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
 (1)写出Cu2O跟稀硝酸反应的化学反应方程式3Cu2O+14HNO3=6Cu(NO3)2+2NO
+7H2O;
(1)写出Cu2O跟稀硝酸反应的化学反应方程式3Cu2O+14HNO3=6Cu(NO3)2+2NO
+7H2O;
 (2)产物中硝酸铜的物质的量0.025mol;
(2)产物中硝酸铜的物质的量0.025mol;

 (3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是0.005mol、0.005mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是0.005mol、0.005mol;
 (4)如混合物中Cu的物质的量为X,求X的取值范围(0.005、0.015)。
(4)如混合物中Cu的物质的量为X,求X的取值范围(0.005、0.015)。
24.(8分)接触法制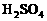 的尾气中
的尾气中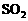 可用碱性溶液氨水吸收,吸收达到饱和后的溶液再与93%的硫酸反应,可放出
可用碱性溶液氨水吸收,吸收达到饱和后的溶液再与93%的硫酸反应,可放出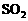 并得
并得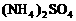 溶液.此法可制得较纯
溶液.此法可制得较纯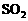 .将
.将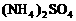 溶液结晶、分离、干燥后可制得固体硫酸铵肥料.
溶液结晶、分离、干燥后可制得固体硫酸铵肥料.
(1)写出有关反应的化学方程式;
(2)某厂每天排放含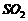 体积分数为0.2%的尾气
体积分数为0.2%的尾气 ,问每天要消耗同温同压下(设标准状况)的氨气多少立方米?可得硫酸铵多少千克?
,问每天要消耗同温同压下(设标准状况)的氨气多少立方米?可得硫酸铵多少千克?
2m3 5.89g
23.(6分)有一瓶澄清的溶液,其中可能含有H+ 、NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、NO3-、SO42-、CO32-、C1-和I-。取该溶液进行以下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后,CCl4层呈紫红色;
⑶另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。根据上述实验事实确定:
 在该溶液中肯定存在的离子是H+ 、NH4+、Ba2+、I-,
在该溶液中肯定存在的离子是H+ 、NH4+、Ba2+、I-,
 肯定不存在的离子是Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-NO3-
肯定不存在的离子是Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-NO3-
 不能确定是否存在的离子是K+、Na+ C1-。
不能确定是否存在的离子是K+、Na+ C1-。
22.(12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 正 极。

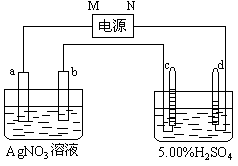 (2)Pt电极上生成的物质是 银 ,其质量为2.16g。
(2)Pt电极上生成的物质是 银 ,其质量为2.16g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶2∶1/2∶1。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同)不变,AgNO3溶液的pH不变 ,H2SO4溶液的浓度 增大 ,H2SO4溶液的pH _减小__。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 45.18 g。
21.(12分)我国许多煤矿的硫含量比较高,将其直接燃烧产物排人大气既会造成“大气污染”,还会形成“酸雨”造成“水污染”。SO2在雨水中的存在形式为(写化学式) H2SO3 。
某校课外活动小组的同学收集几瓶雨水,进行以下实验:
(1)甲同学用试管取少量雨水滴入几滴品红溶液,振荡后品红不褪色,由此他的结论是该雨水不含SO2。他的
结论错误(填“正确”或“错误”);因为 。
 (2)乙同学也用试管取少量雨水,滴入足量BaCl2溶液,发现有少量白色浑浊,写出该实验的化学反应方程
(2)乙同学也用试管取少量雨水,滴入足量BaCl2溶液,发现有少量白色浑浊,写出该实验的化学反应方程
 式:BaCl2+H2SO4=BaSO4 +2HCl,乙同学应该得出的结论是:雨水中含硫酸
式:BaCl2+H2SO4=BaSO4 +2HCl,乙同学应该得出的结论是:雨水中含硫酸

(3)丙同学将乙同学所作实验浑浊溶液过滤,先滴入几滴稀HNO3,再加入BaCl2溶液,又发现白色浑浊。
滴人稀HNO3的化学反应方程式为:3H2SO3+2HNO3=H2SO4+2NO +H2O;丙同学应该得出的结论是:雨水中还含有H2SO3。
20.(8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
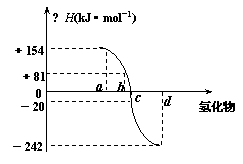 ⑴写出氧族元素中含有18e-的两种氢化物的电子式 略
。
⑴写出氧族元素中含有18e-的两种氢化物的电子式 略
。
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关
 系:△H越小非金属元素氢化物越稳定
系:△H越小非金属元素氢化物越稳定
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方
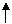
程式:H2Se(g)=Se(s)+H2 (g)
19.(6分)叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有(a、c)(答案可能不止一个)
a、离子键 b、极性共价键 c、非极性共价键
(2)配平下列反应的离子方程式
5 N3- + 7 MnO4- + 26 H+ → 7 Mn2+ + 13 ____H2O__ + 15 NO
(3)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有关反应的
化学方程式3NaN3====4N2+Na3N
18.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
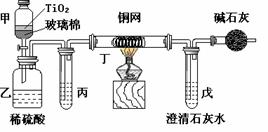
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
|
⑴甲中反应的离子方程式为 ClO- +CN- ======CNO- +Cl- ,
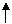
乙中反应的离子方程式为 3ClO- +2CNO- +2H+= 2CO2 +N2+H2O +3Cl- 。
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作
用是 除去HCL 气体 ,丁在实验中的作用是 除去CL2 ,装有碱石灰的干燥管的作用是 防止空气中的二氧化碳进入戊中影响实验结果 。
⑶戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理
的百分率等于 82 % 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因
有部分的二氧化碳气体留在装置中。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 通入氮气 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com