
题目列表(包括答案和解析)
19.(10分)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
m |
d |
e |
|
|
|
f |
|
|
|
|
|
|
|
|
|
|
|
g |
|
|
h |
i |
|
|
|
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
⑴上述所列元素的原子中,最外层电子层上只有两个电子的是___________ (填“元素符号”).
⑵下列叙述正确的是__________________.
A.k的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于h的氢化物的热稳定性
C.f与h形成化合物水溶液的pH大于f与i形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性h弱于i
D.原子半径:k>g>e>a
⑶m元素的单质中有一种称为足球烯的分子m60,它可能最易发生的反应是 。
A.消去反应 B.取代反应
C.加成反应 D.聚合反应
⑷由a、d、e三种元素形成的化合物中,能促进水电离的是__________________(填一种物质的化学式,下同);能抑制水电离的是_______________; 最近科学家们合成了dn+5,电子式为 ,则n值为
。
,则n值为
。
⑸将等物质的量的f、g的单质投入足量水中,向反应后的溶液中逐滴加入浓度为1 mol·L-1的盐酸溶液,至100 mL时沉淀达到最大值,则投入f的物质的量为________mol.
18.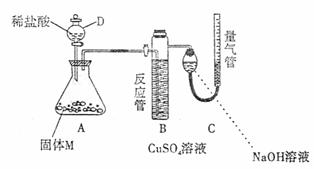 (16分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。
(16分)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。
根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是 。
(2)固体M中一定有的物质是 (写化学式)。
(3)写出A中发生反应的化学方程式(只写一个):
。
(4)写出B中析出黑色沉淀时发生反应的离子方程式 。
(5)根据题给条件,固体M中一种物质的质量可以确定,应为 g(用代数式表示)。
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是 (写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是 。
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为: 。
A.KSCN溶液 B.NaOH溶液 C.氨水
17.(6分)下列实验操作或对实验事实的描述不正确的是____________________(填序号,错选一个倒扣2分,不出现负分)
① 用量筒量得稀硫酸溶液8.0mL;②用热的浓HCl洗涤附着有MnO2的试管;③在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;④ Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑤用碱式滴定管量得KMnO4溶液20.50mL ;⑥ 实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑦配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
16.微型钮扣 电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
Ⅱ卷非选择题 共86分
15.向一定量的Fe、Fe3O4的混合物中,加入200mL 1mol/L的盐酸,恰好使混合物完全溶解,放出448mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( )
A.68.6% B.81.4% C.77.8% D.无法计算
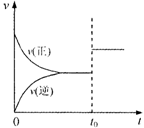
14.可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
13.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在阳极逸出n mol气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4溶液的质量分数为( )
A.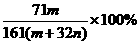 B.
B.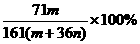
 C.
C.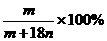 D.
D.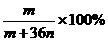
12.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+) = c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3) = c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
10.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
|
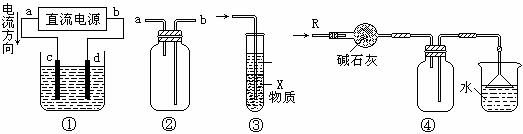 11.关于下列各装置图的叙述中,不正确的是( )
11.关于下列各装置图的叙述中,不正确的是( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
9.下列各组离子在所给条件下能大量共存的是( )
A.在滴加酚酞试液呈红色的溶液中: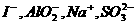
B.在pH=0的溶液中: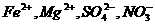
C.由水电离出的c(H+)=1×10-12mol/L的溶液中: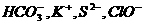
D.加入单质硅能产生H2的溶液中: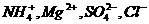
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com