
题目列表(包括答案和解析)
22.(10分)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
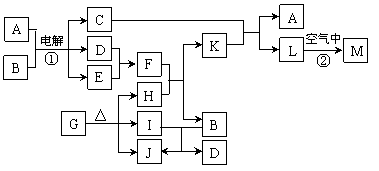
⑴基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
⑵写出K和E反应的离子方程式_______________________________________。
写出F溶液和H反应的离子方程式___________________________________。
⑶已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为________。
21.(10分)现有原子序数依次增大的A、B、C、D四种短周期元素,已知A、D同主族,B、C、D同周期,A、D的原子序数之和等于B、C的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)A、B、C、D的元素符号分别为_______、______、______、______;
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为_____________;
(3)B单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为
__________________________________________________________________;
(4)D单质能跟B的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为
__________________________________________________________________。
20. (12分) 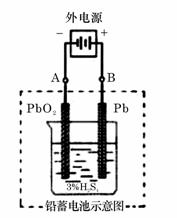 铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-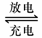 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将________________________。
19.(6分)(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
18. (8分)酸碱中和滴定是用已知浓度的酸(或碱)滴定未知浓度的碱(或酸)。
(8分)酸碱中和滴定是用已知浓度的酸(或碱)滴定未知浓度的碱(或酸)。
现小张同学用酸式滴定管准确量取25.00mL某未知浓度的盐酸溶液于一洁
净的锥形瓶中,然后用0.200mol/L的NaOH溶液滴定(指示剂为酚酞)。
(1)小张同学首先配制150 mL.0.200 mol/L NaOH溶液,右图是该同
学转移溶液的示意图,图中的错误是______________________________、
_________________________________________________________。
(2)若配制标准溶液的NaOH中混有Na2CO3杂质,会导致实验结果
________________。
(3)滴定结果如下:
|
|
NaOH起始读数 |
NaOH终点读数 |
|
第一次 |
0.10mL |
18.60mL |
|
第二次 |
0.30mL |
18.60mL |
|
第三次 |
0.20mL |
22.10mL |
根据以上数据可计算出盐酸的物质的量浓度为________________。(保留2位有效数字)
17.(22分)回答下列问题:
(1)(8分)在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析……下列各组混合物的分离或提纯应选用什么方法最合适,若需多步操作,请按顺序填写。
①除去苯中含有的少量苯酚____________________________;
②分离CuSO4·5H2O和BaSO4的混合物___________________。
③向鸡蛋白水溶液中加入少量的___________(填一种试剂),再 (填操作名称),可得较纯的鸡蛋白固体。
(2)(3分)中和热测定的学生实验中,用到的玻璃仪器有烧杯、温度计、 、 ,提高测定中和热准确性的关键是 。
(3)(7分)在测定硫酸铜结晶水的实验操作中:加热前应将晶体放在_______中研碎,加热是放在_______中进行,加热失水后,应放在_____________中冷却。判断晶体是否完全失水的定性方法是:_________________________________________________。做此实验,最少应进行称量操作_______次。
(4)(4分)制取少量乙酸乙酯的实验中加热试管的目的是:① ;
② 。
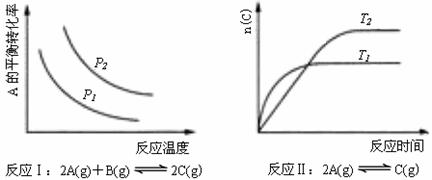
16.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以下规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1

第Ⅱ卷(非选择题 共86分)
15. 右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
14.已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
A.向甲容器中充入一定量的氦气 B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
13.下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com