
题目列表(包括答案和解析)
5.为了从新制的氯水中制得高浓度的HClO,可向氯水中加入的试剂是 ( )
A.Na2CO3 B. H2SO4 C.CaCO3 D. Ca(OH)2
4.下列有关说法不符合事实的是 ( )
A.同温同压下,气体的体积取决于气体的物质的量的多少
B.氧化剂的氧化性强弱取决于该氧化剂中某元素化合价的高低
C.用焰色反应检验K+时须透过蓝色钴玻璃观察
D.元素的相对原子质量取决于该元素各核素的相对原子质量和在自然界中的原子百分比
3.下列说法正确的是 ( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
2.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,因为炉气中SO2会与杂质反应
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
1.今年4月22日是第37个“世界地球日”,宣传主题是“善待地球--珍惜资源、持续发展”。 下列说法不符合这一主题的是 ( )
A.启动沿海风力发电,创建绿色能源之都
B.分类回收生活垃圾,合理利用变废为宝
C.大力发展生态农业,创建生态安全城市
D.化工企业集中选址,尽量减少污染区域
24.硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4∶1):
3FeS2 + 8O2 → Fe3O4 + 6SO2 ①
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 ②
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为多少?以此种黄铁矿为原料制取硫酸,再用硫酸制取硫酸铵。燃烧75t黄铁矿生产出79.2t硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的损失率为多少?
(2)把1.00g含脉石(SiO2)的黄铁矿试样在氧气中灼烧后,得到0.78g残渣,则黄铁矿的纯度为多少?
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
(4)480 g纯净的FeS2在空气中完全反应,若所得固体中,Fe和O的物质的量之比n (Fe)∶n(O) =4∶a,此时消耗空气为bmol。试写出b与a的关系式:___________________。
23.某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品过氧化钠的质量。
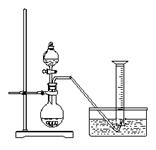 实验步骤:
实验步骤:
①称取过氧化钠固体2.00 g ;
②把这些过氧化钠放入气密性良好的气体发生装置中;
③向过氧化钠中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
(1)有1 000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒。
(2)生成气体体积是 mL, 为保证生成气体体积的准确性读取量筒刻度时应注意的问题是 。
(3)据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (偏高或偏小)。
(4)为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。配平化学反应式方程式:
KMnO4 + H2O2 + H2SO4 -- K2SO4 + MnSO4 + O2↑ + H2O
该实验应选用 式滴定管。
(5)通过以上数据计算,该过氧化钠的纯度为 。
(6)如何避免因为生成H2O2造成的误差? 。
22.(8分)
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________________________。
(2)ZW2的电子式是______________,它在常温下呈液态,形成晶体时,属于_________晶体。
(3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是___________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。
21.(8分)
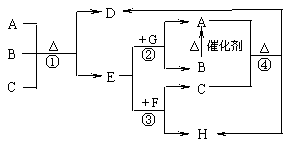 下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
请回答下列问题:
(1)写出D的化学式 。
(2)写出反应①的离子方程式
③的离子方程式
(3)在反应①中每生成1molE,转移电子数为 mol。
20.(6分)
有A、B、C、D四种电解质,它们均由多种元素组成(元素的原子序数均小于20),相同浓度溶液的pH值是A<B<C<D,且只有A的pH小于7,四种物质的焰色反应皆显黄色,A与B、C、D都能反应,但仅与B、C反应产生无色无味的气体。向A溶液中加入Ba(NO3)2溶液,能产生不溶于硝酸的白色沉淀。试推断A、B、C、D的化学式并写出B和D反应的离子方程式。
(1)A: B: C: D:
(2)B和D反应的离子方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com