
题目列表(包括答案和解析)
29. (8分)在一定温度下,向一个容积不变的容器中通入2mol氮气和8mol氢气及固体催化剂,使之反应。已知:
(8分)在一定温度下,向一个容积不变的容器中通入2mol氮气和8mol氢气及固体催化剂,使之反应。已知:
平衡时容器内气体的压强为起始时的80%。
(1)平衡时容器内氨气的体积分数φ=_____________。
(2)加入2mol氮气和8mol氢气,反应达到平衡时,放出热量为_________(填序号)。
A.小于92.2kJ B.等于92.2kJ
C.大于92.2kJ D.可能大于或小于或等于92.2kJ
(3)在相同容器中,降低温度,通入2mol氨气和1mol氢气及固体催化剂,反应达到平衡时氨气的体积分数,下列判断正确的是_________(填序号)。
A.一定等于φ B.一定大于φ
C.一定小于φ D.可能大于或小于或等于φ
(4)保持同一温度,在相同的容器中,起始通入一定物质的量氮气、氢气、氨气,欲使平衡时氨气的体积分数也为φ,且起始时反应表现为向正反应方向进行,则充入氮气的物质的量a(mol)的取值范围_______________。
28.(5分)燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为___________________________________________。
(2)该燃料电池的电极反应式为:
电池正极 13O2+52e- 26O2-
电池负极 2C4H10+26O2--52e- 8CO2+10H2O
则固体电解质中的O2-向________极移动(填“正”或“负”)
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为____,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是________g(结果精确至0.01g)。
27. (8分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(8分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式:D______________;X______________。
(2)在反应①-⑦中,不属于氧化还原反应的是________________(填编号)。
(3)反应④的离子方程式为:_________________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________________________。
(5)反应⑦的化学方程式为___________________________________________;
该反应中每消耗0.3mol的A,可转移电子__________mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为___________________________________。
26.(5分)短周期的六种元素A、B、C、X、Y、Z,原子序数依次变小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成10电子化合物Q;C与X处于同周期,B+与C2-的核外电子排布相同,A与B处于同周期,且形成BA型化合物。请回答:
(1)化合物Q的空间构型为_______________;化合物YC2电子式是________________;
(2)A、B、C的离子半径由大到小的顺序为____________________(用元素离子符号表示);
(3)元素组成为XZ5YC3和BCZ(足量)化合物反应的离子方程式为________________________;
(4)工业上,若输送元素A的单质的管道漏气,用Q进行检验时可观察到大量白烟,同时有X的单质生成,写出有关反应的化学方程式__________________________________________。
25.有氧化铜和三氧化二铁的混合物ag,加入2mol/L的HCl溶液50mL,恰好完全溶解,若将2ag该混合物在CO气流中加热并充分反应,冷却后,剩余固体的质量为( )
A.(2a-1.6)g B.(2a-3.2)g C.1.6ag D.0.8ag
请将以下各题的正确答案填写在答题纸上
24.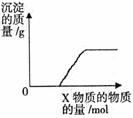 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如右图,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如右图,符合图中情况的一组物质是( )
|
|
A |
B |
C |
D |
|
X |
Ba(HCO3)2 溶液 |
Na2CO3 溶液 |
KOH 溶液 |
CO2 气体 |
|
Y |
NaOH 溶液 |
CaCl2 溶液 |
Mg(HSO4)2 溶液 |
石灰水 |
23.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到2molFe(OH)3沉淀,此间共消耗水的物质的量为( )
A.2mol B.3mol C.4mol D.5mol
22. 在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH=Q
在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH=Q
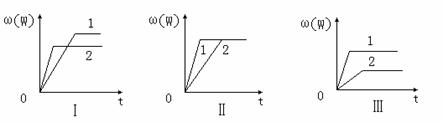 某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
21.将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到溶液中离子浓度关系不正确的是( )
A.c(K+)>c(Na+)> c(H+)>c(OH-)
B.c(Na+)+ c(K+)+ c(H+) = 2c(SO42-)+ c(HS-)+ c(OH-)+2c(S2-)
C.c(SO42-)> c(HS-)> c(OH-)> c(H+)
D.c(K+) = c(S2-)+ c(H2S)+c(HS-)+c(SO42-)
20.一定温度下,取0.2 mol/L HX溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化,下同)得溶液甲;另取0.2 mol/L HX溶液与0.1 mol/L NaOH溶液等体积混合得溶液乙。测得溶液甲的pH=8,溶液乙的pH>7。下列结论错误的是( )
A.甲溶液中由水电离出的c(OH¯) > 0.2 mol/L HX溶液中由水电离出的c(H+)
B.甲溶液中c(Na+) - c(X-)=1.0×10−8 mol/L
C.甲溶液中c(OH-) - c(HX) =1.0×10−8 mol/L
D.相同条件下,HX的电离程度 > NaX的水解程度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com