
题目列表(包括答案和解析)
4.下列相关实验现象的分析中,错误的是 ( )
A.在铜锌原电池中,锌片上也有气泡可能是因为锌片中含有杂质
B.向酸性KMn04溶液中通入乙炔,溶液长时间不褪色可能是因为溶液浓度太大
C.用标准NaOH溶液滴定盐酸,测得盐酸的浓度偏大,可能是先用待溅液润洗了锥形瓶
D.将Ba(OH)2·8H20和NH4Cl混合搅拌,无明显降温现象,.可能是因所用的反应物是晶体
3.下列叙述中正确的是 ( )
A.FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔现象
B. C9H12的芳香烃其同分异构体只有五种
C.为检验甲酸中是否混有甲醛,可先蒸馏,然后再用蒸出物做银镜反应
D.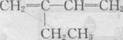 的名称是2-乙基-1,3-丁二烯
的名称是2-乙基-1,3-丁二烯
2.硝酸铵是一种常用的化肥,在高温或撞击下容易发生分解反应而燃炸:
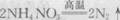
 则下列有关该反应的说法正确的是 ( )
则下列有关该反应的说法正确的是 ( )
A.氧元素被还原,氮元素被氧化
B.有两种元素的化合价发生了变化
C.生成的气体与转移电子的物质的量之比是10:3;
D.该反应的熵变△S<O、焓变△H<0
1.良好的环境是社会和谐发展的保证。下列说法中不正确的是 ( )
A.北京奥运会的火炬燃料是丙烷,符合举办“绿色奥运”的承诺
B.火箭常用偏二甲肼、四氧化二氮作燃料,这两种物质对环境无污染
C.2007年太湖部分水域发生“水华”等污染是水体富营养化的结果
D.研究人员用植物纤维制造出的机动车燃料,属清洁的可再生能源
23、(7分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)现在要除去1m3含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝__________g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_____________________________。
②已知金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水质量是多少?
22、(10分)已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O(化学计量数a~k均为正整数)。回答下列问题:
(1) 根据反应中离子的电荷守恒,可得b、c、d、f的关系式是(用一个代数式表示。下
同)
(2) 根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
(3) 根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是
(4) 若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。
21、 (10分)物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。
(10分)物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。
(1)若A是常见金属的氢氧化物,且A+OH-→B,A+H+→C,写出:B→C的离子方程式
,B与C (填“能”或“不能”)共存。
(2)若A是酸性氧化物,且分子空间构型为直线型,B、C的焰色反应为黄色,相同条件下B的溶解度小于C的溶解度。则A的电子式是 ,B的俗名是 。写出:B固体→C固体的化学方程式 。
20、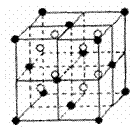 (9分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
(9分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (填化学式);
A和D的电负性较大的是 (填元素符号);
B和C的第一电离能较小的是 (填元素符号);
A和B的离子中,半径较小的是 (填离子符号);
构成C单质晶体的微粒以 键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如上图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。与一个“〇”距离最近的“●”有____个,与一个“●”距离最近的“●”有______个,该化合物的化学式是 。
19、(11分)按要求完成下列问题:
(1)写出基态Fe的电子排布式和Mg2+ 轨道表示式 、 。
(2)指出配合物K3[Co(CN)6] 中的中心离子、配位体及其配位数: 、 、 。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角 、 、 。
(4)若Pt(NH3)2 Cl2分子是平面结构,请画出Pt(NH3)2 Cl2可能的结构简式
、 。
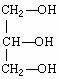
(5)下列分子若是手性分子,请用“ *”标出其手性碳原子。
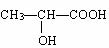
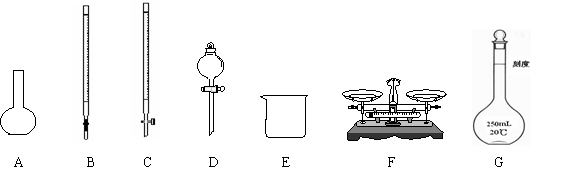
18、(10分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
 请根据上面叙述,回答:
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com