
题目列表(包括答案和解析)
6、设NA为阿伏加德罗常数,下列叙述中正确的是
A.14g乙烯和丙烯的混合物中总原子数为3NA个
B.18 g D2O中含有的质子数目为10NA
C.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
D.5.6g铁与足量的稀硫酸反应失去电子数为0.3NA个
5、下列各种说法正确的是
A.分解、潮解都是物理变化;风化、酯化都是化学变化
B.NH3分子间易形成氢键;H、Cl原子之间易形成极性共价键
C.用电解法可以制得Na、Al;用热还原法可以制得Ag、Hg
D.臭氧的体积分数超过10-14%的空气有利于人体的健康
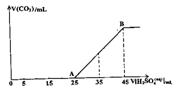
29.(11分)将5.0g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,
然后向该溶液中逐滴加入2mol·L-1的硫酸溶液,所加入硫酸溶液的体积与产生CO2的
体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL硫酸溶液时,产生二氧化碳的体积(标准状况)是 mL。
(3)若硫酸溶液用量达到上图B点时,经测定溶液中C(Na)为1mol/L,则溶液中
C(SO )为
(设溶液体积的变化忽略不计)。
)为
(设溶液体积的变化忽略不计)。
(4)原混合物中氢氧化钠的质量分数为 。
27.从物质A开始有如下图所示的转化关系(其中部分产物已略去)。已知1molF与足量新制的Cu(OH)2在加热条件下充分反应可生成2mol红色沉淀。分析图表并回答问题:

(1)A中含有的官能团的化学式为:
写出下列物质的结构简式:B I
(2)指出反应类型:D→G H→I
(3)写出下列反应的化学方程式:
C→F
E→H
E→M
(4)已知一个碳原子上有两个羟基为不稳定结构,与C含有相同种类及数目的官能团的同分异构体共有5种(不包括C),除CH2(OH)CH(OH)CH2CH3、CH2(OH)CH2CH2CH2OH外,另外三种的结构简式
、 、 。
 28.(19分)某学校研究性学习小组对过量炭粉与Fe2O3反应的产物中气体的成分进行分析。
28.(19分)某学校研究性学习小组对过量炭粉与Fe2O3反应的产物中气体的成分进行分析。
(1)假设:该反应的气体产物全部是CO2
(2)设计方案:将一定量Fe2O3在隔绝氧气的条件下与过量的炭粉完全反应,测定参加反应的碳元素与氧元素的质量,计算出反应产物中碳、氧原子的物质的量比。
(3)查阅资料:N2不与碳、Fe2O3发生反应。实验室可以用氯化铵溶液和亚硝酸钠溶液混合加热制得N2。
①写出实验室制取N2的离子方程式 。
②该实验装置与实验室制取下列气体的装置相同的是 (填标号);
a.用稀盐酸与锌反应制H2
b.用MnO2浓盐酸共热制Cl2
c.用NH4Cl与Ca(OH)2共热制NH3
其主要玻璃仪器除酒精灯外,还包括 、 。
(4)实验操作步骤、现象:
①实验前要 。
 ②称取3.2g Fe2O3与2.0g炭粉混合均匀,放入质量为48.48g的玻璃管中,按上图所示装置进行实验。
②称取3.2g Fe2O3与2.0g炭粉混合均匀,放入质量为48.48g的玻璃管中,按上图所示装置进行实验。
③加热前,先进行的操作是 ,
其目的是 。
④夹紧T处弹簧夹,加热一段时间,证明有CO2气体
生成的现象是 。
⑤反应完全后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g。
(6)结论:根据数据处理结果,得出原假设不成立,理由是 。
(7)根据数据处理结果,反应生成的气体是 ,且气体的物质的量之比为 。试写出该反应的化学方程式 。
26.(17分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、X均为化合物,G在常温下为液态。它们之间的转化关系如下图所示(其中某些反应条件和部分反应产物已略去)。

(1)A元素位于周期表中 周期 族。
D的化学式 ;X的电子式 。
(2)在反应①-⑥中,不属于氧化还原反应的是 (填编号)。
(3)往F溶液中加入NaOH溶液观察到的现象是 。
(4)已知反应⑥中消耗9g气态G放出a KJ的热量,试写出该反应的热化学方程式:
;
该反应中每消耗0.6mol的A,可转移电子 mol。
(5)写出下列反应的离子方程式:
D的水溶液与小苏打溶液混合 。
向含有3mol F的溶液中通入4mol Cl2的离子反应方程式为
。
13.下列叙述正确的是 ( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:
CH3OH+8OH-6e CO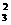 +6H2O
+6H2O
C.在铁上镀铜时,金属铜作阴极
D.电解精练铜时,电解质溶液中铜离子浓度不变
12.常温下,某酸HA溶液和某碱BOH溶液的pH相同,两溶液混合后,溶液的pH=7,下列判断中合理的是 ( )
|
编号 |
HA |
BOH |
溶液的体积关系 |
|
|||
|
① |
强酸 |
强酸 |
V(HA)<V(BOH) |
|
|||
|
② |
强酸 |
强酸 |
V(HA)=V(BOH) |
||||
|
③ |
强酸 |
弱酸 |
V(HA)>V(BOH) |
||||
|
④ |
弱酸 |
强酸 |
V(HA)>V(BOH) |
||||
A.①③ B.②③ C.②④ D.①④
11.在25℃101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
P4(s)+5O2(g)=P4O10;△H=-3 093.2kJ·mol-1 ①
4P(s)+5O2(g)=P4O10;△H=-2 954.0kJ·mol-1 ②
由此判断下列说法正确的是 ( )
A.白磷在空气中加热至260℃可转化红磷
B.已知白磷分子为正四面体结构,则P-P健之间的夹角为109°28′
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
10.2.0mol+Pl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下列反应:
 PCl3(g)+Cl2(g) PCl5(g);达平衡时,PCl5为0.40mol。如果此时移走1.0mol
PCl3(g)+Cl2(g) PCl5(g);达平衡时,PCl5为0.40mol。如果此时移走1.0mol
|
A.0.40mol B.0.20mol
C.小于0.20mol D.大于0.20mol,小于0.40mol
9.下列各组离子在指定溶液中一定能大量共存的是 ( )
①加入Al能放出H2的溶液中:Fe2+、Al3、NO3、Cl、S2
②使pH=11的溶液中:Na、AlO2、NO3、S2、SO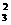
③由水电离的c(H+)=10-12mol·L-1的溶液中:Cl、HCO2、NO3NH4、F
④加入Mg能放出H2的溶液中:Mg2+、NH4、Cl、K、SO
⑤使甲基橙变戏的溶液中:Fe3+、NH4、Cl-、K、SO
A.①③④ B.①②④ C.②④⑤ D.①②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com