
题目列表(包括答案和解析)
16.(12分)
(1)碱性(1分)
ClO- + H2O  HClO + OH- (2分)
HClO + OH- (2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空1分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (1分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (1分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请
你选择其中一题作答,如果两题全做,则按A题评分。
21A.《物质结构与性质》(12分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是________________________________________________________________。
(3)NH4+中氮原子的杂化类型为 ,NH4+的空间构型为 。
(4)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是__________________
_____________________________________________________________________________________________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_____________________
_____________________________________________________________________________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时_________先液化。
21B.《实验化学》(12分)
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属
反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下: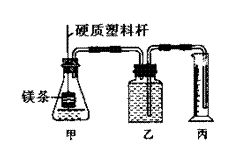
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:
。
(2)量取10.00mL 1 mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)
A.50mL量筒 B.10mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁带质量不能少于 g。
(4)步骤⑤中需记录的数据是 ;实验过程中观察到的主要现象是
。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为 (填“偏大”、“偏小”或“无法确定”)
(6)为保证实验顺利进行,仪器丙应选用的规格是 (填序号字母)。
A.100mL B.200mL C.500mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为 L·mol-1。
15、(4分)B、D、F、G(答对1个得1分,答错1个倒扣1分,扣完为止,本题不出现负分)
20.(10分)甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产
物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
19.(12分)
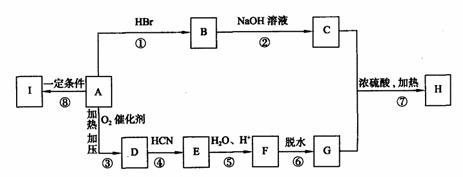 下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。
下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。
请回答下列问题:
(1)物质D和I的结构简式为:D 、I 。
(2)指出反应类型:反应④属 ;⑥属 。
(3)写出下列反应的化学方程式:
反应②
反应⑦
(4)写出与H具有相同官能团且只含有一个甲基的同分异构体的结构简式(除H外,
请写出任意两种) , 。
 17.(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
17.(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
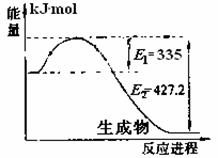
(1)右图是N2和H2反应生成2molNH3过程中能
量变化示意图,请计算每生成1molNH3放
出热量为 。
(2)在定体积的密闭容器中,进行如下化学反应:
 N2(g)+3H2(g) 2NH3(g),其化学平衡
N2(g)+3H2(g) 2NH3(g),其化学平衡
常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl-)>c(N2H2+6)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)>c(OH-)>c(H+)
C.2 c(N2H2+6)+c([N2H5·H2O]+)+ c(H+) = c(Cl-)+c(OH-)
D.c(N2H2+6) > c(Cl-)> c(H+) >c(OH-)
18.(12分)汞单质及其化合物在工业生产和科学研究上有广泛的用途,汞唯一重要的矿源是朱砂(HgS)。朱砂炼汞的反应之一为:
HgS+O2 Hg+SO2
请回答下列问题:
(1)HgS与O2的反应中,氧化剂是 ,每生成1molHg转移电子的物质的是为 mol。
(2)电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是 (填化学式),由此可推断断得知该盐的化学式是 。其阳极上的电极反应式是 。
(3)随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。以下处理含汞(Hg2+)废水的方法中最简单实用的是 (填序号)。
A.向含Hg2+的废水中加入Na2S等可溶性硫化物
B.加入金属还原剂
C.电解法
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象; 假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是___________________________。
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:_____________________________
______________________________________________________________________
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
14.一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL0.6mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为
A.3︰1 B.3︰2 C.2︰3 D.3︰4
第Ⅱ卷(共72分)
13.常温下,将一元酸HA溶液和一元碱BOH溶液等体积混合,所得溶液呈酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA一定是弱酸
B.若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com