
题目列表(包括答案和解析)
16.(10分)废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一。某兴趣小组进行如下探究:
[实验课题]废旧聚丙烯塑料热分解主要产物的探究
[查阅资料]①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
[实验设计]
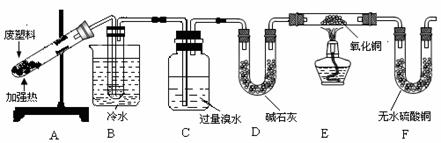
[实验记录]
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝。
[问题讨论]请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要除去其中的甲苯,实验操作方法是 ;
(2)C装置的作用是 ;
(3)如果不设置D装置,对实验结论产生的影响是 ;
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分。你认为其他成分可能是
。为完善实验设计,请在上图方框内画出装置图并注明其中盛放的试剂名称。
15(A).[物质结构与性质]
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
A |
|
|
|
|||||||||
|
|
|
B |
|
|
C |
|
|
||||||||||
|
|
|
|
|
|
|
D |
E |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素D的基态原子电子排布式 ;
(2)D、E两元素的部分电离能数据列于下表:
|
元 素 |
D |
E |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难。对此,你的解释是 ;
(3)A的氢化物的中心原子的杂化形式为 ;C在空气中燃烧产物的分子构型为 ,与其互为等电子体的单质的分子式为 。
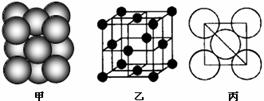 (4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为
。
(4)B单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中B原子的配位数为 ,一个晶胞中B原子的数目为
。
15(B).[实验化学]
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图,。
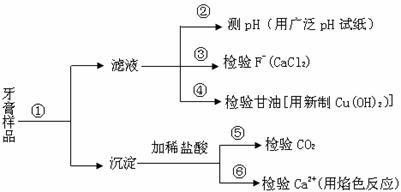
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是 ,所需要的主要玻璃仪器有 。
(2)在②中用pH试纸测溶液的pH的操作方法是 。
(3)写出④中发生反应的化学方程式: 。
(4)将⑤中放出的气体通入澄清的石灰水中时,未见沉淀出现,则可能的原因是 、
(任答两条)。
(5)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和 溶液的反应来进行。
14.在1 L的密闭容器中,充入1 mo1CO和1 mo1 H2O (g),于850℃时进行化学反应:CO(g) + H2O (g)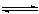 CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O
(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O
(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
|
时间/min |
n(CO)/ mo1 |
n(H2O)/mo1 |
n(CO2)/ mo1 |
n(H2)/
mo1 |
|
0 |
1 |
4 |
0 |
0 |
|
4 |
0.25 |
3.25 |
0.75 |
0.75 |
|
6 |
n1 |
n2 |
n3 |
n4 |
|
8 |
n1 |
n2 |
n3 |
n4 |
|
t |
0.15 |
3.15 |
0.85 |
0.85 |
A.前4 min,用CO表示的化学反应速率为v(CO)=0.25mol/(L·min)
B.反应在第4 min时处于化学平衡状态
C.8分钟时,混合气体中CO2的体积分数为16%
D.t分钟时,反应所处的温度高于850℃
13.草酸是二元中强酸,测得0.01 mol·L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是
A.V(NaOH) = 0时, c(Na+)> c(H+)> c(HC2O4- )> c(C2O42 -)> c(OH-)
B.V(NaOH) = 5时, c(Na+)=c(C2O42 -)+c(HC2O4- ) +c(H2C2O4)
C.V(NaOH) = 10 mL时, c(Na+) = c(HC2O4- )+2c(C2O42 -)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
12.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,正确的是
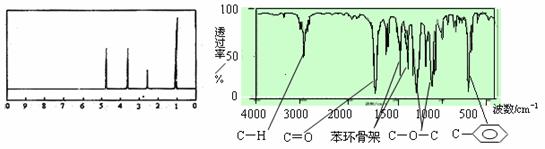
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
11.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A. 25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
B.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移约0.2×6.02×1023个电子
C.1 mol羟基(-OH)所含的电子数约为10×6.02×1023
D.标准状况下,测得一定量的铜与硝酸反应后生成22.4 L的混合气体 ,则被还原的硝酸的分子数应大于6.02×1023
10. A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是
A.A、C两元素处在元素周期表中的第ⅥA族
B.B、D两元素组成的离子化合物中阴、阳离子的个数比为1∶1
C.B、C、D三种元素组成的化合物的化学式为DCB2
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,
但只要选错一个该小题就为0分(本大题包括6小题,每题4分,共24分)。
9. 下列反应方程式书写正确的是
A. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O = AgOH↓+ NH4+
B. 钢铁发生吸氧腐蚀的正极反应:4OH--4e- = 2H2O + O 2↑
C. 20mL0.1mol/LAlCl3溶液中加入70mL0.1 mol·L-1NaOH溶液:2Al3++7OH- = Al(OH)3↓+AlO2-+2H2O
D. 向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3•H2O+H2O
8. 右图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入
右图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入 gM和
gM和 gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是
gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液
C.t1℃时,M、N的溶质质量分数一定相等
D.t2℃时,M、N的物质的量浓度一定相等
7.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有
关说法中,不正确的是
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.NH5固体投入少量水中,可产生两种气体
D.1molNH5中含有5 mol N-H键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com