
题目列表(包括答案和解析)
5. 中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A. 用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B. 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C. 用沸点数据来分析分子的稳定性
D. 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
4. NA表示阿伏加德罗常数,下列说法中正确的是( )
A.3.6 g重水中所含质子数为2NA B.1 mol S与足量Cu反应生成Cu2S转移NA个电子
C.1molCH4分子中共价键总数为4NA D.4.48 L N2所含分子数为0.2 NA
3. 下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 ②用NaOH溶液除去苯中的少量苯酚 ③用饱和NaHCO3溶液除去CO2中的少量SO2 ④用加热的方法提取NH4Cl固体中混有的少量碘 ⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐 ⑥用米汤检验食用加碘盐中含碘 ⑦用碘酒验证汽油中含有不饱和烃
A. ①②④⑤⑦ B. ②③⑤⑦ C. ②③④⑤ D. ①②③④⑤⑥⑦
2. 关于离子键、共价键的各种叙述中,下列说法中正确的是 ( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,将于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是( )
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
21.(10分)江苏东海有蛭石。蛭石为一种层状结构的含镁的水铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/3的Si被Al置换,再由K平衡其电荷形成的。
该矿石得组成以氧化物的形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
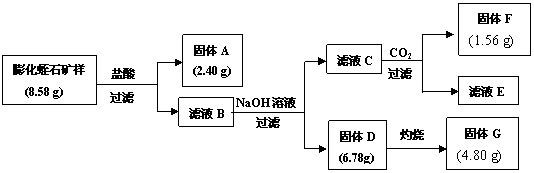
①固体A的化学式是
②固体F的物质的量是
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式
20. (12分)阿司匹林能迅速解热、镇痛。长效缓释阿司匹林可在体内逐步水解而疗效更佳。用丙酮为主要原料合成长效缓释阿司匹林的流程如下图。
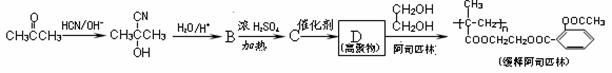
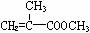 回答下列问题:
回答下列问题:
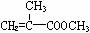 (1)上述合成C的路线曾用作有机玻璃单体(
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
,其化学方程式为: 。
(1)上述合成C的路线曾用作有机玻璃单体(
)合成路线的一部分。现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6 MPa条件下羰基化,一步制得
,其化学方程式为: 。
如此改进的优点为: 。
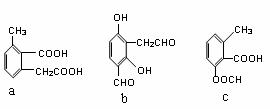 (2)阿司匹林的结构简式为
,下列物质与阿司匹林互为同分异构体的有
(填字母编号)。
(2)阿司匹林的结构简式为
,下列物质与阿司匹林互为同分异构体的有
(填字母编号)。
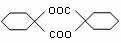
(3)根据题示信息,用苯酚为主要原料合成 ,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH浓硫酸170℃CH2=CH2高温、高压催化剂 CH2-CH2
CH2-CH2
19.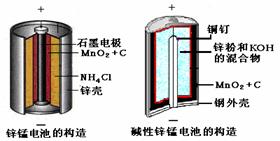 (10分)请仔细观察两种电池的构造示意图,回答下列问题:
(10分)请仔细观察两种电池的构造示意图,回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是
(3)某工厂回收废旧锌锰电池,其工艺流程如下:
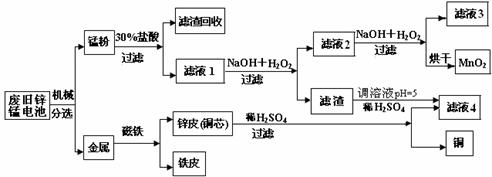
已知:生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
8.0 |
9.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2 。
②第一次加入H2O2后,调节pH=8.0。目的是 。
③试列举滤液4的应用实例 。
18.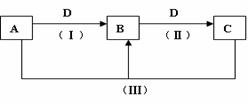 (8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为 。
(2)A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ)的化学方程式为 。
(3)D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是 。
(4)D为酸或酸性气体,则A、B、C、D可以是 (请按顺序写出合理任意一组物质的化学式即可)。
17.(10分)北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是 。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com