
题目列表(包括答案和解析)
18、有四种钠盐溶液A、B、C、D,其酸根均可用RO3n-表示(n≤2,其中R为短周期元素,且原子序数依A→D递增),现将它们取适量两两混合,并用足量硫酸酸化,其中两组实验现象如下:
|
组别 |
混合液 |
现象 |
|
I |
A、C |
白色沉淀和无色气体 |
|
II |
B、D |
无色气体 |
且知实验后I、II组所得溶液中均只含有同一种钠盐
(1)写出各酸根离子的符号A______B________C_____________D________
(2)写出两组实验中发生反应的离子方程式
I.
II.
17、北京2008年奥运会金牌直径为70毫米,厚6毫米。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉譬造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物形式为___________
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体生成,当不再产生气体时,金牌残留一金黄色外壳。将产生的气体与11.2L氧气(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸。再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀,最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344L(标准状况)。已知:Au+HNO3+4HCl=H[AuCl4]+NO+H2O.
①该金牌所含黄金质量为_________
②该金牌除含黄金外还含有另外一种金属是_____,其质量是_____g.
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下:
____Au+____KCN+___H2O+____O2----K[Au(CN)2]+___KOH
①配平方程式,将系数填在横线上。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为 ______________
16、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO↑+2H2O
高锰酸钾、碳酸钠、氧化亚铜、硫酸铁四种物质中的一种物质(甲)能使上述过程发生。
(1)写出并配平该氧化还原反应的方程式 _______________
(2)反应中硝酸表现出__________的性质
(3)反应中若产生0.2mol气体,则转移电子的物质的量是_________mol
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________
15、类比是化学学习中常用的方法之一,已知硝酸能把铁氧化为硝酸铁,但当铁过量时,产物是硝酸亚铁。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当氯气足量时生成氯化铁,当铁粉过量时产物是氯化亚铁。为判断该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的氯气中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是氯化铁,B是氯化亚铁
(2)设计实验方案,分别取A、B的溶液进行以下实验,但实验现象相同。请填写下表中的空格。
|
实验方法 |
实验现象 |
结论 |
|
分别向A、B溶液中加入硫氰化钾溶液 |
|
固体物质中有氯化铁 |
|
分别向高锰酸钾溶液中加入适量A、B溶液 |
高锰酸钾溶液颜色均无明显变化 |
固体物质中不含 ____ |
(3)根据上述实验结论,写出氯气与铁粉加热时发生反应的化学方程式 ____________________
(4)为进一步探究氯化铁溶液的性质,他又用A溶液做了如下一些实验,其中明显错误的是__________
A、将A溶液沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B、向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C、在A溶液中滴加氢氧化钠浓溶液,出现红褐色沉淀
D、将A溶液加热蒸干并灼烧,得到氯化铁固体
(5)实际应用:氯化铁溶液作印刷电路板腐蚀剂,腐蚀后的废液中含有氯化铁、氯化亚铁、氯化铜,某研究性学习小组的同学们设计了两种从废液中回收铜的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为 _____________
方案2:在废液中加入适量的盐酸调节溶液的PH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的铜已全部析出。方案2中铜作________极,所发生的电极反应为 _____________________ (若有多个电极反应,请按照反应发生的先后顺序全部写出)
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要为_________________
14、现有部分短周期元素的性质或原子结构如下表:
|
元素代号 |
元素性质或原子结构 |
|
T |
M层上的电子数为6个 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7 |
下列叙述正确的是
A、元素X的一种同位素可测定文物年代,这种同位素的符号是12C
B、元素Z的非金属性比元素T弱
C、Y和T位于同一主族
D、T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸
13、下列操作会使实验结果偏高的是
A、用已知浓度的氢氧化钠滴定盐酸时,酸式滴定管放液前未排气
B、硫酸铜结晶水含量的测定实验中,灼烧后晶体已部分变黑
C、中和热测定实验中,倒入氢氧化钠过于迟缓
D、配制一定物质的量浓度溶液,定容时仰视读数
12、现有一包铝热剂是铝和氧化铁的混合物,在高温下使之充分反应,将反应后的固体分为两等分,常温下进行如下反应(忽略溶液体积变化和盐的水解):
①向其中一份固体中加入100 mL2mol/L的氢氧化钠溶液,加热使其充分反应后过滤,测得滤液的pH=14。
②向另一份固体中加入140mL4mol/L的盐酸溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+、Al3+三种阳离子且pH=0。
有关说法正确的是
A、铝热剂中铝的物质的量是0.01mol
B、铝热剂中氧化铁的质量是4 .8克
C、①中生成的氢气的体积为 3.36L(标准状况)
D、②反应后所得溶液中氯离子浓度为1mol/L
11、可逆反应A(g)+3B(g)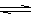 2C(g) ;△H=-QkJ/mol(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述正确的是
2C(g) ;△H=-QkJ/mol(Q>0).有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述正确的是
A、甲中反应达到平衡时,Q1=Q
B、达到平衡时,甲中C的体积分数比乙大
C、达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动
D、乙中的热化学反应方程式为2C(g) 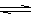 A(g)+3B(g); △H=+Q2kJ/mol
A(g)+3B(g); △H=+Q2kJ/mol
10、假定把12C的相对原子质量定为24,把24克12C含有的原子个数作为阿佛加德罗常数,则下列推断不正确的是
A、此时16O的相对原子质量为32
B、标准状况下,44克二氧化碳的体积为22. 4L
C、40克氢氧化钠溶于水配成1L溶液,其物质的量浓度为1mol/L
D、NA个氧分子与NA个氢分子有相同数目的分子
9、下列现象或结果一定不可能出现的是
A、在溴化钠溶液中滴加几滴硝酸银溶液,产生淡黄色沉淀,再加入稀硝酸,沉淀不溶解,但溶液由无色变为黄色
B、在浓硝酸中滴加几滴紫色石蕊试液,加热最终变为无色溶液
C、葡萄糖与新制的氢氧化铜悬浊液混合,然后用水浴加热,看不到红色沉淀
D、过量的铁在氯气中燃烧,最终产物是氯化亚铁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com