
题目列表(包括答案和解析)
27.(10分)(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 ;不溶于水,且密度比水小的是 。
(2)一瓶无色气体,可能含有CH4和CH2==CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
。
②上述实验可能涉及的反应类型有 。
(3)含有 的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是
。
②电器包装中大量使用的泡沫塑料的主要成份是聚苯乙烯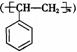 ,它是由 (写结构简式)聚合而成。
,它是由 (写结构简式)聚合而成。
26.(10分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
25.(10分)工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%)
 |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1) 已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
24.(10分)往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:

⑴精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],
反应的化学方程式为 。
⑵合成反应后,继续在393K-523K下水热处理8h,发生反应:
[Mg(OH)2-xClx·mH2O]==(1- )Mg(OH)2+
)Mg(OH)2+ MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是 。
⑶ 阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是 。
⑷ 已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g); △H1=+81.5kJ·mol-1
Al(OH)3(s)=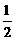 Al2O3(s)+
Al2O3(s)+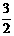 H2O(g); △H2=+87.7kJ·mol-1
H2O(g); △H2=+87.7kJ·mol-1
① Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
② 等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
⑸ 常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是 (填代号),理由是 。
23.(10分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
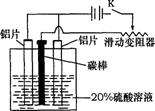 (1) 配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 gNaOH固体。
(1) 配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 gNaOH固体。
(2) 把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极 。
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程
发生反应的离子方程式
22.(10分)实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

请回答下列问题:
(1)操作I的名称为 ,操作II所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W 1g和W 2g,则样品中KBr的质量分数计算式为 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。

21. (10分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
(10分)某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在FeCl2 否 ___(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 是 ___(填“是”或“否”),你的判断依据是 气体通过浓硫酸减少4.4 8L 。
⑶写出反应④的离子反应式: AlO-+ H++HO ==Al(OH__ 。
⑷请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
由题中信息可推得一定含有g,所以一定没题中信息可推得一定含有g含含,所以一定没有A有A
lCl 题中信息可推得一定含有g,所以一定没含有A 。
⑸把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶。往浓盐酸后,再加热浓 缩析出晶体
_________________________________________________________________________ 。
20.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn + 2 MnO2十H2O = ZnO + 2MnO (OH)2。下列说法正确的是 D
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2e一+ 2H2O = 2MnO (OH)2十2OH-
第Ⅱ部分(非选择题 共80分)
19.下列各溶液中,微粒的物质的量浓度关系正确的是 AD
A 1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B 1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-)
C 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
18. 可逆反应aX(g)+bY(g)
可逆反应aX(g)+bY(g)  cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是D
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是D
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com