
题目列表(包括答案和解析)
2.(14分)
(1)冷凝、回流(1+1分)。防止倒吸(2分)。
|
(2)S+2H2SO4(浓) 3SO2↑+2H2O(2分,无加热符号、气体符号扣1分)
(3)取样后,向其中加入氯氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可)(2分)
(4)CuO、CuS、Cu2S(或CuO、CuS可CuO、Cu2S)(2分)
(5)铜与浓硫酸反应的实验中硫酸过量使溶液呈酸性(2分)。取稀释后的溶液适量于试管中,加入足量的铁粉,若有无色无味的气体产生,证明硫酸过量(开放题,正确即可)
1.(10分)(1)漏斗、烧杯、玻璃棒
;(2)2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(3)将所得的滤液E加热煮沸一定时间(或向滤液中加入足量的NaOH溶液),
再进行过滤、洗涤、干燥,最后进行高温灼烧。
(4)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2- ,
只有Fe(OH)3沉淀。(5)8MgO·Al2O3·Fe2O3·4Si
6.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成__________________________________________________________________________________________________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ____________ 。 ②_____________ ____________ 。 ③____________ _____________ 。 ④ H2O使布条褪色 |
实验1:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验2:_______________ ______________。 实验3:把红色布条放在水里,布条不褪色。 |
__________ __________ __________ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3  HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3) =
4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3) =
4.45×10-7
HCO3- CO32- + H+
Ka2(H2CO3) = c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+
Ka2(H2CO3) = c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO)
= 2.95×10-8
H+ + ClO- Ka(HClO)
= 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中_________________________ ;
②氯气和碳酸钠按照1∶1的比例恰好反应_______________________;
③将过量的氯气通入到少量的碳酸钠溶液___________________。
2008届高三化学实验题练习
5. (12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O
(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
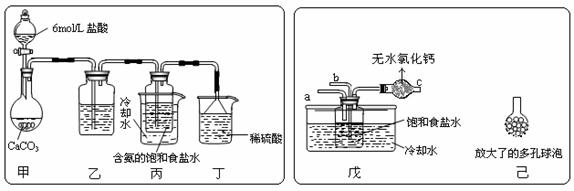
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ; (Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅰ)乙装置中的试剂是 ; (Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:
4.锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1000℃-1200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通人CO2得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热l-2 h,经过滤、洗涤,得到碳酸锶。
(1) 方法一将天青石粉碎的目的是__________________
__________________
。写出用碳还原天青石反应的化学方程式:_____________________________________。
(2) 方法二的反应能够发生,说明______________
____
。为了使该反应充分进行,还可以采取的措施是__________ 。
(3)两种方法中得到的碳酸锶纯度较高的是_______________(填“方法一”或“方法二”),理由是______________________________________________
。
(4)下列关于锶及其化合物的叙述中,正确的是___________。
A.离子半径:Ba2+>Sr2+>Ca2+ >Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2
3.2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。(12分)
 (1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
流程探究不同催化剂对NH3还原NO反应的催化性能。
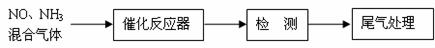
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,
将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574
kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
(3)①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C  4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
2.(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
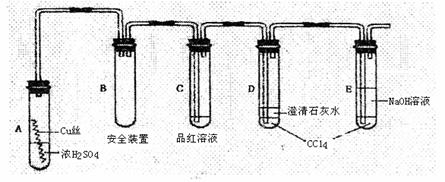 实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录。
|
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
。
1.(10分) 江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。
某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
I、相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成
②氢氧化物开始沉淀及沉淀完全时的pH
|
氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
|
沉淀的pH范围 |
1.5~4.1 |
9.4~12.4 |
3.3~5.2 |
 Ⅱ、相关实验:
Ⅱ、相关实验:
Ⅲ、实验数据:
① 矿石样品质量为:8.22g
② 实验过程中得到固体的质量:A-2.40g、 D-2.14g 、 F-1.56g
③ 每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题
(1)过滤操作需要的玻璃仪器有:
(2)写出由D制一种红色颜料的化学方程式:
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你分析滤液E中可能含有成分,设计一个从滤液E制取耐火材料的实验方法:
(4)滤液B和NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为:
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式
29.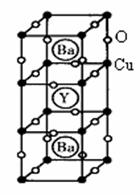 (10分)新型节能材料高温超导体的最先突破是在1987年
(10分)新型节能材料高温超导体的最先突破是在1987年
从新的钇钡铜氧材料的研究开始的。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价(铜元素的原子序数为29)。
(1)写出铜在周期表中的位置(周期和族)
(2)写出Cu3+的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
。
(4)根据(3)所推出的化合物的组成及各元素的化合价 (该化合物中Y、 Ba元素的化合价分别为+3价、+2价),计算化合物中两种价态Cu原子个数比为: 。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
28.(10分)21、为测定某有机化合物A的结构,进行如下实验。
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗
氧气6.72L(标准状况下)。则该物质中各元素的原子个数比是 ;
(2)质谱仪测定定机化合物的相对分子质量为46,则该物质的分子式是 ;
(3)根据价键理论,预测A的可能结构并写出结构简式 。
(4)核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值,根据峰值可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl-CH2-O-CH3)有两种氢原子(图4)。经测定,A的核磁共振氢谱示意图如图5,则A的结构简式为 。
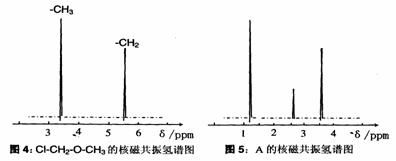
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com