
题目列表(包括答案和解析)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是_______________________________________________________________。
(3)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是___________________
____________________________________________
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
班级 姓名 学号 成绩
20. 某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
|
物质 |
甲 |
乙 |
CO |
H2 |
|
燃烧热/kJ·mol-1 |
1366 |
5518 |
283 |
286 |
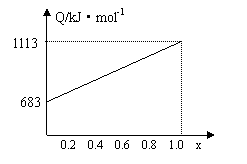 取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如右图。试求:
取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如右图。试求:
⑴ 乙的相对分子质量Mr(乙) ;
⑵ 160g由甲、乙等物质的量混合而成的燃油
在347.2LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合物中C、H、O的原子个数比 。
甲、乙的分子式为:甲 ;乙 。
⑶1mol由甲、乙等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ·mol-1,则反应中生成CO mol。
19、(10分)一氯乙酸(ClCH2COOH)是无色晶体,可溶于水,其水溶液显酸性,是重要的有机反应中间体,可进行多种反应。
(1)一定条件下,一氯乙酸与苯可直接合成苯乙酸,其反应方程式是______________________ (不要求标出反应条件)。
(2)工业上将一氯乙酸、2–丙醇与浓硫酸混合加热制备一氯乙酸异丙酯,一氯乙酸异丙酯的结构简式为____________________________________ ;反应过程中,可能产生的有机副产物有异丙醚[(CH3)2CHOCH(CH3)2]和________________________(填结构简式)。
(3)pKa常用于表示物质的酸性强弱,pKa的数值越小,该物质的酸性越强。已知卤素原子对饱和脂肪酸的酸性影响具有相似性。25℃时一些卤代饱和脂肪酸的pKa数值如下:
|
卤代酸 |
F3CCOOH |
Cl3CCOOH |
F2CHCOOH |
FCH2COOH |
 CH3CH2CHCOOH CH3CH2CHCOOH |
|
pKa |
0.23 |
0.65 |
1.24 |
2.66 |
2.85 |
|
卤代酸 |
ClCH2COOH |
BrCH2COOH |
ICH2COOH |
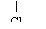 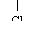 CH3CHCH2COOH CH3CHCH2COOH |
CH2CH2CH2COOH |
|
pKa |
2.86 |
2.90 |
3.18 |
4.06 |
4.52 |
可见,25℃时卤素原子对卤代饱和脂肪酸的酸性影响有(写出2条即可):
①___________________________________________________________________;
②____________________________________________________________________;
根据上述数据和规律判断, Cl2CHCOOH的pKa的数值范围为_________________。
18、(11分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)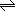 CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是____________________________________________________
__________________________________________________________________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_______________________________________________________________
____________________________________________________________________。
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。
17、(11分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:
 Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
根据流程图回答下列问题:
(1)“煅烧”的目的是________________________________________________________。
(2)配制质量分数15%的盐酸需要200mL30%的浓盐酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(3)“溶解”过程中发生反应的离子方程式为____________________________________
___________________________________________________。
(4)加少量铝粉的主要作用是_____________________________________。
(5)“调节溶液pH在4.2-4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90-100℃,控制温度的实验方法是_________________。
16.(8分)你留意过标签上的化学吗?
(1)这是某品牌休闲西服标签上的部分内容:
|
等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100% |
 |
|
熨烫标准:中温,不超过150℃ |
回答 ①其中属于合成纤维的是____________
②从此标签中可感觉羊毛、绦纶两种纤维的共同点有________。
③将面料、里料中各抽出一根来点燃,可观察到的现象是_______。
(2)某化肥厂生产的一种化肥,其包装袋上标有:
|
硝酸铵(NH4NO3) 净重 50kg 含氮量≥31.5% |
 |
①该厂生产的每一袋这种化肥中NH4NO3的质量应不少于_____kg。
②某些汽车的安全气囊中也装有NH4NO3,它在高温或猛烈撞击时,会迅速反应,产生大量气体,从而避免驾驶员受伤。其原理是:2NH4NO3→2N2↑+O2↑+4H2O↑
③在使用此化肥时,你最想关照农民大哥的事情是 (至少说出两点)。
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是___________________________。
(5)基于假设②,结论是___________________________________________,请设计实验进一步验证该结论,叙述实验操作:_____________________________________________________________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
14、
第II卷 (非选择题共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com