
题目列表(包括答案和解析)
23.(13分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤I中反应的化学方程式为:
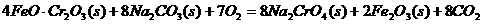 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加)。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
22.(8分) 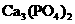 、
、 均为难溶于水的白色固体.某同学向
均为难溶于水的白色固体.某同学向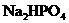 溶液中滴加
溶液中滴加 溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是
溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是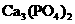 还是
还是 。(已知:
。(已知: 水解程度大于电离程度)
水解程度大于电离程度)
|
实验原理______________________________________________________ 实验用品及试剂:烧杯、玻璃棒、表面皿、试管、滴管;石蕊试液、酚酞、pH试纸 |
|
实验步骤、现象及结论:(可以不填满) A.___________________________________________________________ B.___________________________________________________________ C.___________________________________________________________ D.___________________________________________________________ E.___________________________________________________________ |
21.(9分)为了探究硫化钠晶体(Na2S•nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中。②三天后将样品放入盛水的烧杯中,搅拌后得无色澄清溶液。③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。
⑴请你根据上述记录猜想所放出气体的成分可能是(至少写出三种)
________________________________________________________________________。
⑵若所放出气体为两种气体的混合气体,请使用品红溶液、浓溴水、澄清石灰水三种试剂设计一个组合实验分析该混合气体的组成,简要写出实验方案、现象和结论。
|
实验方案 |
可能的现象和相应的结论 |
|
|
|
|
|
⑶如果要检验硫化钠晶体是否被氧化生成了硫酸钠,请简要说明检验的方法、现象和结论(可在兴趣小组实验的基础上设计实验):____________________________________
________________________________________________________________________。
20、常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/ c(H+)=1012 ,将这两种溶液等体积混合,以下离子浓度关系判断正确的是
A.c(H+)<c(OH-)<c(A-)<c(B+)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(A-)= c(B+)>c(H+)=c(OH-)
D.c(H+)+ c(B+)= c(OH-)+ c(A-)
19.近年用红外激光技术研究液氢,发现范德华力也可以引起微粒间反应,已知在液氢中有氢分子和质子形成的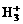 离子,其构型为等边三角型,属于二电子三中心离子。同时
离子,其构型为等边三角型,属于二电子三中心离子。同时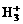 和氢分子可进一步形成
和氢分子可进一步形成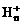 。有关判断正确的是
。有关判断正确的是
 A.
A.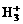 的电子式为
的电子式为
B.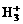 可进行反应,在液态氢中形成
可进行反应,在液态氢中形成 、
、 、
、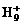
C.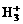 可在液态氢中形成
可在液态氢中形成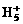 、
、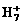 、
、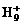
D.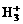 广泛存在于固态、液态和气态氢中
广泛存在于固态、液态和气态氢中
18. 将1mol H2 (g) 和2mol I2 (g) 置于某2L密闭容器中,在
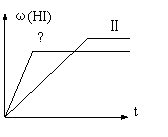 一定温度下发生反应:
一定温度下发生反应:
H2(g)+
I2(g) 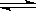 2HI(g) △H<0, 并达到平衡,HI的体
2HI(g) △H<0, 并达到平衡,HI的体
积分数ω(HI)随时间变化如图(II)所示。若改变反应
条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的
条件可能是
A.恒温恒容条件下,加入适当催化剂 B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度 D.恒温条件下,扩大反应容器体积
17.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目、Ca(OH)2的溶解平衡
16.下列说法均摘自某科普杂志,你认为无科学性错误的是
A.铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于植物的光合作用
D.用加酶洗衣粉洗涤衣服时,热水比温水差
15.高铁酸钾是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,往高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应为:2Fe(OH)3 +3ClO -+4OH- =2FeO42- +3Cl- +5H2O ,
干法制备的主要反应为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
下列有关说法不正确的是:
A. 高铁酸钾中铁显+3价
B. 湿法中每生成1mol Na2FeO4 转移3mol电子
C. 干法中每生成1mol Na2FeO4 转移4mol电子
D. K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
14.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是
A.S8转化为S6、S4、S2属于非氧化还原反应
 B.不论哪种硫分子,完全燃烧时肯定都生成SO2
B.不论哪种硫分子,完全燃烧时肯定都生成SO2
C.常温条件下单质硫为原子晶体
D.把硫单质在空气中加热到750℃即可得到S2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com