
题目列表(包括答案和解析)
29.(10分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
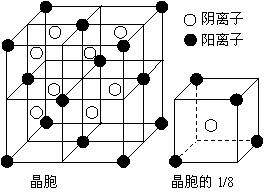 ⑴A和E所形成化合物的电子式是 。
⑴A和E所形成化合物的电子式是 。
⑵A、B、C、D四种元素的原子半径由小到大的顺序为 (用元素符号表示)。
⑶A和D的氢化物中,后者沸点较低,原因是 。
⑷A和E的化合物晶体中,每个阳离子周围与它最近且距离相等的阳离子共有 个。
⑸已知A和E所形成化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数) 。
⑹现代原子结构理论认为,在同一电子层上有s、p、d、f、g、h……等能级,各能级分别有1、3、5……个轨道。2006年有人预言,126号元素(一种极稳定的超重元素)可能与A能形成稳定的化合物,按照元素周期律,126号元素应位于周期表第 周期;请根据元素原子核外电子填充的顺序预测,该元素的价电子排布式应为 。
高三年级第一次调研考试
28.(10分)抗禽流感药物达菲是以莽草酸(A)为原料合成制得。莽草酸可以从香料“八角”中提取,其结构简式如下:
已知:
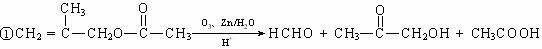
②在NaOH稀溶液中,1molB能与2mol NaOH反应
③F转化为G时,产物只有一种结构且能使溴水褪色
④各物质之间存在下图所示的转化关系:
 ⑴写出化合物A中所有官能团的名称
⑴写出化合物A中所有官能团的名称
⑵写出F→G的反应类型:
⑶写出D的结构简式:
⑷已知B的同分异构体有下列性质:①与FeCl3溶液作用显紫色;②与新制的Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物只有2种。写出同时符合以上要求的B的同分异构体结构简式:
⑸在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为手性碳原子。试设计一步反应使A生成具有2个手性碳原子的物质,其化学方程式为:
27.(10分)某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源。已知制酒精的方法有三种:
 ①在催化剂作用下乙烯与水反应
①在催化剂作用下乙烯与水反应

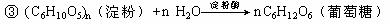
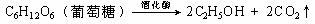
⑴方法①的化学反应方程式是
⑵方法②的化学反应类型是
⑶为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?请简述理由 。
⑷如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是( )
A ① B ③ C ①③ D ②③ E ①②③
⑸乙醇分子中的氧原子被硫原子取代后的有机物叫乙硫醇,其性质与乙醇相似,但乙硫醇有酸性,它能与NaOH等强碱溶液反应生成无色溶液。石油中因含乙硫醇(无色液体,微溶于水)使汽油有臭味且其燃烧产生的二氧化硫会污染环境,因此要把它除去。
①用化学方法除去石油样品中的乙硫醇,请写出有关反应的化学方程式
②乙硫醇与乙酸在一定条件下可发生酯化反应,写出该反应的化学方程式
③在120℃、1.01×105Pa时,将乙醇、乙硫醇的混合蒸气1L和5LO2混合,充分燃烧后,恢复到原状况,气体密度减小为燃烧前混合气体的10/11,则乙醇和乙硫醇的体积之比为 。
(四)请你参与以下探究:
⑴实验A反应速率明显比B小,原因是: ;
⑵根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”你认为是否有道理,理由是:
②某同学作了如下猜想,是否成立?请你设计实验方案加以验证。
|
猜想 |
验证方法 |
预测现象及结论 |
|
认为铜片中可能含有锌等杂质 |
|
|
⑶某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资料卡片①②资料大胆猜想,白色沉淀可能是CuCl。”请你帮他设计验证方案(若有多个方案,只设计两个):
|
猜想 |
预设验证方法 |
猜想的现象及结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了实验中的白色沉淀是CuCl;并指出生成沉淀的原因,实际上是[CuCl4]3-等离子与CuCl(s)、Cl-三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示)
26.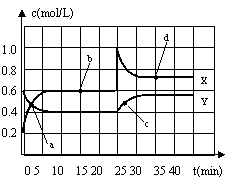 (10分)已知NO2和N2O4可以相互转化:2NO2(g)
(10分)已知NO2和N2O4可以相互转化:2NO2(g)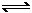 N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如右图所示。
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如右图所示。
⑴图中共有两条曲线X和Y,其中曲线 表示NO2浓 度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
⑵①前10min内用NO2表示的化学反应速率
v(NO2)= mol·L-1·min-1;
②15min时,反应2NO2(g)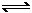 N2O4(g)在b点的浓度平衡常数K(b)=
;
N2O4(g)在b点的浓度平衡常数K(b)=
;
③反应进行至25min时,曲线发生变化的原因是 ;
④35min时,反应2NO2(g)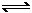 N2O4(g)在d点的浓度平衡常数K(d) K(b)(填“大于”、“小于”、或“等于”)。
N2O4(g)在d点的浓度平衡常数K(d) K(b)(填“大于”、“小于”、或“等于”)。
⑶①若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小玻璃容器的体积至1L,气体的颜色变化过程是 。
(三)背景资料
|
资料卡片 主题:生成一价铜的反应 ①必修一,P116: 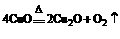 ②《无机化学》下册,P705:Cu2++4I- == 2CuI(白色)↓+I2 ③《无机化学》下册,P706:氯化亚铜(CuCl)在不同浓度的KCl溶液中可形成[CuCl4]3-等无色离子 |
(二)实验记录:
|
交流卡片 主题:Zn、Cu与浓盐酸间的实验 A.将锌放入浓盐酸中,反应较快 B.将锌片与铜片贴在一起,一同放入浓盐酸中,反应快速放出气体 C.当实验B中锌片完全溶解后,将溶液加热,又产生大量气体,得到无色溶液 D.将实验C反应后的溶液隔绝空气,加入适量水,出现白色沉淀 |
(一)实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
24.(9分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
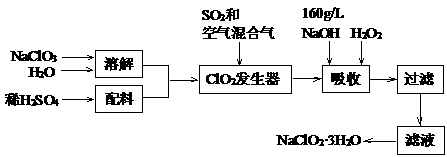
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解。
③HClO2在25℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
⑴160g/LNaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个数据是
⑵ClO2发生器中所发生反应的化学方程式为
⑶吸收塔中为防止产物NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
A.Na2O2 B Na2S C FeCl2 D KMnO4
⑷从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (选填序号);
A 蒸馏 B 蒸发 C 灼烧 D 过滤 E 冷却结晶
要得到更纯的NaClO2·3H2O晶体还必须进行的操作是 (填操作名称)
25.(11分)某研究性学习小组为探究铜、锌与盐酸反应,设计实验探究方案如下:
23.(8分)氯磺酸(ClSO3H)和甲酸(HCOOH)的有关性质如下表:
|
|
颜色、状态 |
沸点(℃) |
密度(g/cm3) |
特性 |
|
氯磺酸 |
无色或淡黄色油状液体 |
151 |
1.77 |
在空气中“发烟”,遇水起剧烈作用 |
|
甲酸 |
无色液体 |
100.8 |
1.22 |
在空气中“发烟”,有强腐蚀性 |
它们可发生反应:HCOOH + ClSO3H ==CO↑ + HCl ↑+H2SO4
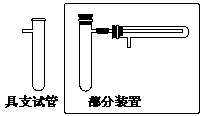 请用具支试管(试管侧壁有一支管)、单孔橡皮塞、玻璃导管、尖嘴玻璃导管及橡胶管来设计一套实验装置,实验目的要求:①混合氯磺酸和甲酸制取CO;②用制得的CO还原氧化铜;③无污染。
请用具支试管(试管侧壁有一支管)、单孔橡皮塞、玻璃导管、尖嘴玻璃导管及橡胶管来设计一套实验装置,实验目的要求:①混合氯磺酸和甲酸制取CO;②用制得的CO还原氧化铜;③无污染。
⑴实验装置的一部分已画于图中的方框内,试将该实验装置补充完整并注明所装的药品(不必画夹持仪器)
⑵实验中混合甲酸和氯磺酸的具体操作方法是 ;混合液体分上、下两层,在两层液体的界面处有少量气泡;轻轻振荡试管,可以加快气泡产生的速率。加快反应速率的可能原因是
22. (10分)某同学设计下图装置进行探究。(夹持装置已略去)
(10分)某同学设计下图装置进行探究。(夹持装置已略去)
⑴进行“铜和稀硝酸反应制取一氧化氮”的实验。
①制取一氧化氮的化学方程式是 ;
②收集气体前必须先 然后才开始收集气体。
⑵利用该装置制取并收集少量其他气体,请完成下表:
|
制取的气体 |
药品 |
|
O2
|
、
|
|
|
某溶液、Al |
⑶利用该装置进行实验,并根据产生氢气的量来确定某酸的结构:
①反应前,先对量气管进行第一次读数。读数时,应注意的操作是 ,并使视线与凹液面最底处相平;反应后,待 时,再对量气管进行第二次读数。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
|
编号 |
酸的质量 |
金属锌的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
1 |
1.45g |
10.0g(足量) |
40
mL |
264
mL |
|
2 |
1.45g |
10.0g(足量) |
30
mL |
228
mL |
|
3 |
1.44g |
10.0g(足量) |
20
mL |
243
mL |
已知该酸的相对分子质量为145。根据上述数据可确定该酸是 元酸;
③如果第二次对量气管读数时仰视,则测得的气体体积将会 (填“偏高”、“偏低”、或“不能确定”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com