
题目列表(包括答案和解析)
1.化学与人们的生活、健康密切相关。下列做法不合理的是 ( )
A.用米汤检验加碘食盐中的碘酸钾(KIO3)
B.向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C.用灼烧和闻气味的方法区别棉织物和纯毛织物
D.用透析的手段净化尿毒症患者的血液
22.(7分)标准状况下进行下列实验:甲、乙、丙各取30.0mL同浓度的盐酸,加入同一种镁铝合金,所取合金质量和产生气体的体积如表所列,求:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
550 |
672 |
672 |
(1)盐酸的物质的量浓度= ;(2分)
(2)合金中Mg的质量分数= ;(2分)
(3)丙实验后,还需向容器中加入1.00mol/L的NaOH溶液 mL才能使剩余合金中的铝粉恰好完全溶解。(3分,此问要有计算过程,否则无分)
21.(12分)草酸晶体的组成可表示为H2C2O4·nH2O,为测定n值,进行下述实验:
①称取Wg草酸晶体配成100.00mL水溶液;
②取25.00mL所配的草酸溶液置于锥形瓶中,加适量的稀H2SO4,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4
K2SO4+10CO2↑+8H2O+2 MnSO4,反应生成的MnSO4的水溶液无色,试回答下列问题:
(1)为保证实验的精确度,实验①中,应从下列仪器中选取的仪器是 。
a.托盘天平(含砝码、镊子) b.50mL酸式滴定管
c.100mL量筒 d.100mL容量瓶
e.烧杯 f.胶头滴管
g.锥形瓶 h.玻璃棒
i.药匙 j.50mL碱式滴定管
(2)实验②中,滴定时KMnO4酸性溶液应装在 式滴定管中。
(3)在滴定过程中,右手振荡锥形瓶,左手控制开关活塞,眼睛注视锥形瓶内溶液的颜色变化,达到终点的标志是 。(已知该反应中不使用指示剂,而用某种反应物自身颜色变化来指示终点。)
(4)若滴定过程中,共同去a mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol·L-1,则n= 。
(5)若滴定终点读数时俯视,则计算的n值可能会 (填“偏大”“偏小”或“无影响”)
20.(8分)下图每一个方框中的字母代表一种反应物或生成物,已知A、B、C、D都是中学化学中常见的单质,且D是淡黄色固体单质。产物J是含A元素的胶状白色沉淀,I为NaC1溶液。度填写下列空白:

(1)L的化学式为 。
(2)实验室配制E的溶液时,应将固体E溶于 。
(3)E+F+L反应的离子方程式为 。
(4)H和H之间反应的化学方程式 。
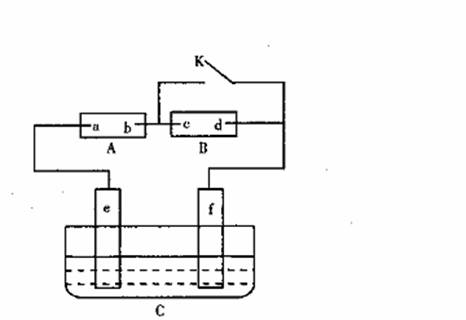
19.(14分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极
(2)滤纸B上发生的总化学方程式为:
|
(4)若A中的总反应为:CH4+2O2+2KOH K2CO3+3H2O,
则a电极反应式为: ;
b电极反应式为: 。
18.(8分)一定温度下的密闭容器内,充入2mol N2、6mol H2发生如下反应:
 N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。
N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。
(1)等温等容时,向该容器中再充入1mol N2、3mol H2,达到平衡时若NH3和体积分数为b%,则a b;若改为等温等压,则a b。(填“>”、“=”或“<”)
 (2)若保持温度容积不变,加入a mol N2、b mol H2、cmol NH2,达到平衡时要使NH3的体积分数仍为a%,则a、b、c应同时满足:
。若改为温度和压强不变,则应满足
。
(2)若保持温度容积不变,加入a mol N2、b mol H2、cmol NH2,达到平衡时要使NH3的体积分数仍为a%,则a、b、c应同时满足:
。若改为温度和压强不变,则应满足
。
17. 在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )
在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.容器中压强不随时间变化而变化
C.气体混合物颜色深浅保持不变
D.混合气体平均相对分子质量保持不变
第Ⅱ卷(非选择题,共49分)
15.有5.1g镁铝合金,投入500mL 3mol·L-1HCI溶液中,金属全部溶解后,再加入4mol·L-1NaOH溶液,若要求在到沉淀最大值,则加入NaOH溶液应为 ( )
A.250mL B.560mL C.375mL D.500mL
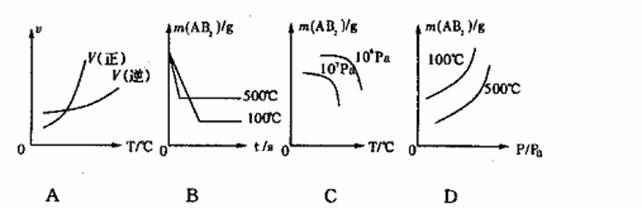
 16.在可逆反应A2(g)+2B2(g) 2AB2(g);△H<0趋向平衡时,下图中符合勒夏特列原理的是 ( )
16.在可逆反应A2(g)+2B2(g) 2AB2(g);△H<0趋向平衡时,下图中符合勒夏特列原理的是 ( )
14.在25℃时,某溶液由水电离出的氢离子的浓度为1×10-12mol/L,下列说法错误的是
( )
|
B.该溶液的pH不可能2
C.向该溶液中加入铝片后,可能生成氢气
D.若该溶液中的溶质只有一种,则它可能是酸,或者是碱,或者是盐
13.在10mL0.1mol·L-tNaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各粒子的浓度关系错误的是 ( )
A.c(Na+)=c(Ac-)+c(HAc)
B.c(Na+)+c(H+)=c(Ac-)+c(OH-)
C.c(Na+)>c(Ac-)>c(H+)>c(OH-)
D.c(Na+)>c(Ac-)> c(OH-)> c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com