
题目列表(包括答案和解析)
18.(6分)(1)否 如果位于同一周期,则其电子数之和应该是3 的倍数;
(2)Y:氮元素 Z:氧元素 W:硫元素;(3)(NH4)2SO4(各1分)
17.(6分)(1)2NH3  NH4+ + NH2- (2分) (2)A、D (2分)
NH4+ + NH2- (2分) (2)A、D (2分)
(3)① H2O;② H2O (2分)
第Ⅱ卷(非选择题,共60分)
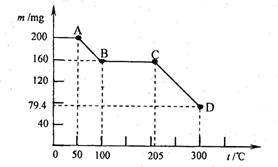 25.(4分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)。试回答下列问题:
25.(4分)下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线(已知草酸锰不稳定,但其中锰元素的化合价在300oC以下不变)。试回答下列问题:
(1)写出B点固体产物的化学式 ▲ ;
(2)从B点到C点过程中固体物质质量不变的
原因是 ▲ ;
(3)通过计算确定D点处产物的相对分子质量,
并推断其合理的化学式。(要写出具体推算过程)
26.(6分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜的质量分数为x。试计算:
(1)所得硫酸铜晶体的质量y(g)的值(用含有x的关系式表示);
(2)若x =0.4,求混酸中HNO3与H2SO4的物质的量之比;
(3)若x=0.4,480g固体混合物与一定量的混酸微热,充分反应后冷却,恰好只能得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数。
高三市统测模拟考化学评分标准
第Ⅰ卷(选择题,共40分)
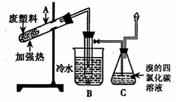
24.(6分)某些废旧塑料可采用下列方法处理:将废塑料隔
绝空气加强热,使其变成有用的物质,实验装置如右图。加
热聚丙烯废塑料得到的产物如下表:
|
产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
 (1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙块。
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙块。
A中残留物
写出反应②、③的化学方程式:② ▲ 、 ③ ▲ ;
(2)试管B收集到的产品中,有一种能使酸性高锰酸钾溶液褪色的物质,其一氯代物有
▲ 种;
(3)锥形瓶C中观察到的现象是 ▲ ,经溴的四氯化碳溶液充分吸收,剩余气体经干燥后的平均相对分子质量为 ▲ ;
(4)写出C中逸出的气体在工业上的一种用途 ▲ 。
23.(7分)有机物A的结构简式是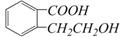 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.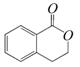 C.
C.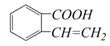 D.
D.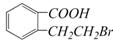
(1)A中官能团的名称是 ▲ 、 ▲ ;
(2)写出由A制取B的化学方程式 ▲ ;
(3)写出由A制取C、D两种物质的有机反应类型:C ▲ 、D ▲ ;
 (4)写出两种既可以看作酯类又可以看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)
(4)写出两种既可以看作酯类又可以看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)
▲ 、 ▲ 。
22.(6分)常温下,某学生用两片质量相等、外形相同、且表面均经过砂纸打磨(完全除掉氧化膜)的铝片,分别与等体积的c(H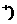 均为3 mol/L的稀盐酸和稀硫酸反应。
均为3 mol/L的稀盐酸和稀硫酸反应。
(1)写出反应的离子方程式 ▲ ;
(2)实验过程中观察反应进行到1、2、5、15、20 min时铝片与酸反应的情况,实验结果如下表:
|
反应进程(min) |
1 |
2 |
5 |
15 |
20 |
|
盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应强烈 |
铝片耗尽 |
|
硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,铝片与盐酸和硫酸反应存在较大差异。这和课本中“铝能与盐酸和稀硫酸反应生成氢气”的说法不一致。假如你将开展实验探究铝片与稀盐酸和稀硫酸反应差异的原因,并设计实验,你将对差异的原因作出哪些假设或猜想(填2种即可):
① 假设(猜想)一: ▲ ,② 假设(猜想)二: ▲ ;
(3)请设计实验验证你的假设或猜想:
① 假设(猜想)一: ▲ ,② 假设(猜想)二: ▲ ;
(4)现欲加快铝与盐酸反应的速率,可采取的方法或措施是 ▲ (任写一种)。
21.(7分) 现有三位同学分别利用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制取少量漂白粉,设计了三套实验装置:
|


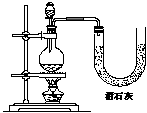
已知温度稍高即发生如下副反应:6Cl2+6 Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O
(1)请从以下几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项编号填在空格内:① 不容易控制反应速率;② 容易控制反应速率;③ 有副反应发生;④ 可防止副反应发生;⑤ 污染环境;⑥ 可防止污染环境。
|
|
优点 |
缺点 |
|
甲装置 |
▲ |
▲ |
|
乙装置 |
▲ |
▲ |
|
丙装置 |
▲ |
▲ |
(2)请从上述装置的A-G的组成中选取合理的部分组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是 ▲ 。
20.(6分)下图为一些常见物质的转化关系图。已知:① 电解C溶液的反应是无机化工生产中的一种重要反应;② Q、M为常见单质;③ F、L是含有同一种元素的化合物,该元
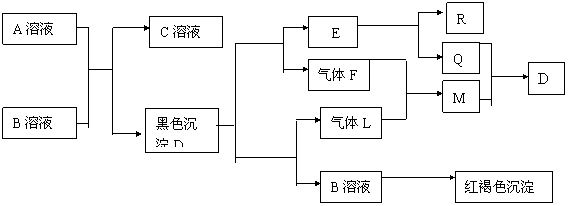 素在两种化合物中的化合价不同。
素在两种化合物中的化合价不同。
Al粉
+ O2 高温
A、B相等物 高温
质的量混合 Δ
稀盐酸
NaClO溶液
试回答下列问题:
(1)B、D的化学式为:B ▲ 、D ▲ ;
(2)完成电解C的饱和溶液的化学方程式 ▲ ;
(3)R与NaOH溶液反应的离子方程式 ▲ 。
19.(6分)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,
HA- H++A2-。试回答下列问题:
H++A2-。试回答下列问题:
(1)Na2A溶液显 ▲ (填“酸性”,“中性”,或“碱性”),理由是 ▲
(用离子方程式表示);
(2)已知0.1mol·L-1NaHA溶液的pH = 2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能 ▲ 0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是_ ▲ ;
(3)0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com