
题目列表(包括答案和解析)
25、二甲醚(CH3OCH3)是一种新型的合成“柴油”。它可由生物甲烷或天然气合成。
⑴生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
若某植物纤维素的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为 m3。
⑵合成二甲醚主要步骤为造气和合成。过程如下:

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其他杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2,且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]= m3;V[空气]= m3。
⑶为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O → CO+3H2 ②2CH4+O2 → 2CO+4H2
合成塔Ⅰ:CO+2H2 → CH3OH ; 2CH3OH → CH3OCH3+H2O
合成塔Ⅱ:N2+3H2==2NH3
假设天然气中只含CH4,反应②中通入适量空气,调节①和②投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰好为3:1,以便合成氨。该企业每生产34t NH3理论上同时可以得到二甲醚多少吨?(设工业多次转化,总转化率假定为100%,设合成塔Ⅰ中水与CO不反应)?
24、⑴100mL含0.001molCa2+的中性溶液让其通过强酸型阳离子交换膜HR,使Ca2+完全被树脂所交换,再用100mL蒸馏水洗涤树脂到中性,将交换液和洗涤液收集在一起,所得混合液(体积为两者之和)的PH为
⑵取10.00g纯碱样品,配成1000mL溶液,取25.00mL放入锥形瓶中,加入某种指示剂,用0.15mol/L的标准盐酸溶液滴定至终点(反应为Na2CO3+2HCl==2NaCl+H2O+CO2↑,杂质不与盐酸反应)。消耗盐酸体积为30.00Ml。试回答下列问题:
取25.00mL溶液所用的仪器是
纯碱样品中碳酸钠的质量分数为
23、环氧树脂用作多种材料黏合剂,某环氧树脂的结构简式为:
可由下列流程进行合成:
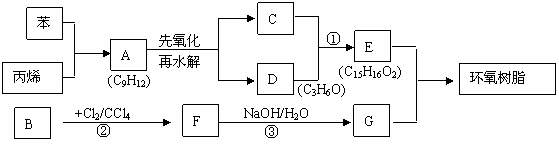
已知A的一氯代物只有5种,C、E遇氯化铁溶液均显紫色,D能发生加成反应,但不能
发生银镜反应,试回答下列问题:
⑴写出结构简式:A B:
⑵写出方程式:
①
③
⑶与A互为同分异构体,且含有苯环的物质共有 种(不含A本身)。
 ⑷已知:RCH2COOH+CH2=CH2+1/2O2
RCH2COOCH=CH2+H2O,请以图中B为原料,合成重要工业品 。提示:①合成过程中无机试剂任选;②只选用本题提供的信息和学过的知识;③合成反应流程图表示方法示例如下:
⑷已知:RCH2COOH+CH2=CH2+1/2O2
RCH2COOCH=CH2+H2O,请以图中B为原料,合成重要工业品 。提示:①合成过程中无机试剂任选;②只选用本题提供的信息和学过的知识;③合成反应流程图表示方法示例如下:

22、在世界逐渐停止使用DDT近30年之后,2006年世界卫生组织发出呼吁,重新提倡使用DDT杀灭蚊虫,抗击疟疾。DDT(滴滴涕)的制备方法是以三氯乙醛、氯苯、三氧化硫为原料合成得到。DDT在土壤中微生物作用下可发生一系列代谢,主要过程如下:试回答下列问题:
⑴分子中所有原子可以处于同一平面的有
(选填“DDT、DDE、DDD、 DDA”)。
⑵DDA中所含的官能团,除苯环外,还有
⑶指出下列有机反应类型:①DDT→DDE 反应;②DDE→DDD 反应
⑷若在实验室也可实现由DDT→-DDE,试写出该反应的化学方程式:
21、水体污染问题是目前是人们十分关注的环境问题之一,下图是某河流受到城市生活污水(主要含有机物)的轻度污染,以及水体自身净化部分示意图。
 请回答有关问题:
请回答有关问题:
⑴图中绘出的三种曲线分别代表氮、磷等无机盐总量,水中氧
气溶解量(DO),有机物溶解量,其中表示水中DO变化曲
线的是 (选填A、B、C、D)
⑵目前推广使用无磷洗衣粉,并提倡科学合理施用化肥,其目的是防止水体
(填与环境相关的术语)。
⑶某研究性学习课题小组拟调查测定本地区水质污染情况,如
果你是课题小组成员,现要取三份不同地区的水样,你选择的三个地点是:
① ② ③
 ⑷氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
,某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法测定。
⑷氨在水体中化学降解时,是水体中两种不同的硝化细菌分两步,将其逐步氧化的,过程如下:
,某同学在该地工业园区取得水样,准备检测其中无机氮的含量,查阅工具书后,决定先检测水样中的铵或氨的浓度,反应原理为2K2[HgI4]+NH4Cl+4KOH==(OHg2NH2)I(红色)+KCl+7KI+3H2O,用比色法测定。
①比色法能测定其中NH3-NH4+的浓度,原理是
②若测得的含量异常偏高,再用其他方法测得NO2-和NO3-含量偏高。可能的原因是
A、可能是硝酸工厂大量排出的含硝酸的废水
B、合成氨厂,刚排放的溶有氨的废水
C、造纸厂排出的有机废水和合成氨厂排出的溶有氨的废水
20、已知A、B为常见金属,J是某主族元素的一种氧化物,该元素+2价比+4价稳定,相同物质的量的C和J分别与I在水溶液中反应时,消耗I的物质的量也相同。它们有下图所示的关系。试回答下列问题:

⑴写出化学式:B: ;L:
⑵写出反应方程式①
④
 ⑶反应②在上世纪七十年代常用水银法替代生产,此法通过钠汞齐(Na·nHg)生产得到的烧碱质量号,浓度高,目前已被离子交换膜法所取代。两种生产方法示意图如下:
⑶反应②在上世纪七十年代常用水银法替代生产,此法通过钠汞齐(Na·nHg)生产得到的烧碱质量号,浓度高,目前已被离子交换膜法所取代。两种生产方法示意图如下:
下列说法肯定不正确的是 (选填A、B、C、D)
A、水银法被淘汰,可能是时汞毒性大,易造成环境污染
B、水银法在电解槽中,阴极的电极反应式为:Na++e-+nHg== Na·nHg
C、离子膜法电解,阳极发生的电极反应为2H+ + 2e- = H2
D、离子膜法烧碱在阴极生成,水银法烧碱在解汞槽中生成
19、元素周期表时学习化学的工具,也为化学的进一步探索与研究提供理论指导,化学学习者和研究者一直关注周期表的运用和发展。试回答下列问题:
⑴2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为
⑵人们研究发现第一周期与第二周期一些元素性质与同族元素性质共性很少,有人建议将氢放在ⅦA,写出一种能支持该观点的化合物: ,人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的“锂键”,请写出(LiF)2含锂键的
结构式:
⑶研究周期表发现存在对角线规则,处在对角线上的元素性质相似,如硼和硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:
18、碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,试回答下列问题:
⑴配平反应器中发生的反应方程式:
I2 + KIO3 + H2O== KH(IO3)2 + KCl + Cl2↑
⑵步骤②中,用硝酸而不用HI,其原因可能是
⑶步骤③要保持溶液微沸1小时,以完全排出氯气,排出氯气的原因为
⑷合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有

⑸用氢氧化钾调节溶液的PH值,发生的反应方程式为:
⑹参照碘酸钾溶解度曲线,步骤得到碘酸钾晶体,你建议的方法是
|
温度 |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
17、苯是法拉第首先发现的,1820~1825年间,他对一种煤气的油状产品产生兴趣并对其进行研究,研究的主要步骤如下:
步骤一:这种油在80℃~87℃区间内蒸馏时,分离出一种新的碳氢化合物。法拉第当时测得这种化合物的熔点为5.5℃,沸点为82.2℃
步骤二:在阳光照射下,让氯气与这种物质作用,生成两种物质。
 步骤三:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),分解成二氧化碳和水,再用装有固体氢氧化钠和无水氯化钙的吸收管完全吸收。
步骤三:这种碳氢化合物蒸汽通过热的氧化铜(催化剂),分解成二氧化碳和水,再用装有固体氢氧化钠和无水氯化钙的吸收管完全吸收。
若0.782g蒸汽分解产生的二氧化碳和水相当于0.721g碳和0.061g氢。试回答下列问题:
⑴步骤一,蒸馏装置如上图,蒸馏的原理是: ,欲蒸馏出苯,加热方式最适宜用: 。
⑵写出步骤二中苯与氯气光照生成对二氯苯的化学方程式:
⑶步骤三中,甲装置盛放的药品是
⑷当时相对原子质量为C=6,H=1,法拉第当时测出的苯的最简式为
16、根据下列有关图象,说法不正确的是

A、由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0
B、由图象Ⅱ知,该反应在t5阶段NH3体积分数最大
C、图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
D、由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
第Ⅱ卷(选择题 共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com