
题目列表(包括答案和解析)
12.下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是: ( )
A.0.1mol/L NaOH溶液与0.1mol/L CH3COOH溶液等体积混合
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.常温下,0.01mol/L NaOH溶液与pH=2的CH3COOH溶液等体积混合
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液混合后使pH=7
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.0.1mol/LCH3COOH溶液和0.1mol/LCH3COONa溶液等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
11.A、B是短周期ⅦA族的两种元素,元素A的非金属性比B强,下列有关A、B的说法中正确的是:( )
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1molHA分子中H-A键断裂时需要吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
10、下列各组顺序不正确的是:( )
A. 粒子半径:S2- > Cl - > F - > Na+ > Mg2+
B. 热稳定性:SiH4 < PH3 < NH3 < H2O < HF
C. 熔点: SiO2 > NaCl > 干冰 > 碘 > 臭氧
D. 还原性:HF < HCl < HBr < HI < H2S
9.锌锰干电池在放电时电池总反应方程式可以表示为:Zn+2MnO2+2NH4+==Zn2++Mn2O3 +2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( ) A.MnO2和NH4+ B.Zn2+和NH4+ C.Zn D.碳棒
8.下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁腐蚀时负极反应 Fe-3e-=Fe3+
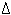 B.Na2SO3溶于硝酸 2H++SO
B.Na2SO3溶于硝酸 2H++SO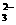 = H2O+SO2↑
= H2O+SO2↑
C.铁粉和硫粉混合反应 2Fe+3S===Fe2S3
D.氯化铵溶液显酸性 NH +H2O
+H2O  NH3·H2O+H+
NH3·H2O+H+
7.对于某些离子或气体的检验及结论一定正确的是( )
A.某气体通入品红溶液,溶液红色褪去,该气体一定是SO2
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO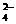
D.向某瓶红棕色气体中,加入氢氧化钠溶液振荡后,得到无色溶液,一定是NO2
6.常温下,下列离子能与H+、Cl-、Fe3+在同一溶液中大量共存的是 ( )
A.Fe2+ B.ClO- C.I- D.HCO3-
12、(16分)0.2mol有机物A在氧气中完全燃烧后,生成79.2gCO2和18g水,同时消耗O247.04L(标准状况),A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):

其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。已知:
①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH-→RCHCHO。
② -ONa连在烃基上不被氧化。
请回答下列问题:
(1)写出结构简式:B:____________I:______________M:________________
(2)上述变化过程中,属于取代反应的是(填编号① ② ③……)______________
(3)写出下列反应的化学方程式(有机物用结构简式表示)。
①G-→F+C: ________________________________________________
②D-→I:_____________________________________________________
③K与过量的Na2CO3溶液反应:__________________________________________
(4)同时符合下列要求的A的同分异构体有__________种。
①含有苯环 ②能发生银镜反应和水解反应
③在稀NaOH溶液中,1mol该同分异构体能与1molNaOH反应
11.(14分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。

试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高、副产品少、产生的有害废物少、保护环境等是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
10.(13分)已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
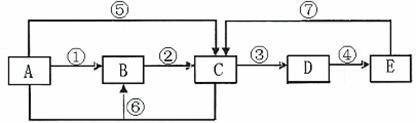
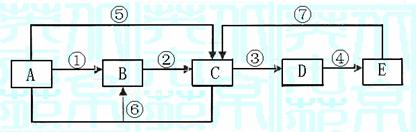
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A→E共同含有甲
元素。可知:B的电子式为 。室温下,将铜片和铁片用导线相连插入足量E的浓溶液中组成原电池,铁片作 极,其电极方程式为: 。当小心加热A与E化合的生成物F时,可能得到一种无色无味的气体G﹝相对分子质量为44﹞和一种无色无味的液体H,写出F分解生成的G+H的化学方程式 。
(2)当A与E反应生成B和C时,则A→E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是 ,在A→E各物质中,一定条件下能与D发生氧化还原反应的物质有
(填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为
(写成化合物、复合物或氧化物均可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com