
题目列表(包括答案和解析)
1、NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是
A、使用适当的催化剂不改变反应速率 B、降低压强能提高反应速率
C、高温度能提高反应速率 D、改变压强对反应速率无影响
5、超声波射线、激光、电磁波等对反应速率均有影响。
超声波作为一种高频机械波,具有波长较短,能量集中 的特点. 可利用超声波增大物质分子运动频率和速度。超声波具有强烈的乳化作用,并能起到均匀搅拌、研磨粉碎和加速化学反应的作用。
激光具有单色性、高强度和短脉宽等优越性能,是诱发光化学反应最理想的光源。例如,激光光解可以产生自由基或原子,所产生的自由基又可以诱发链锁反应。
典例剖析
[例1] 对于反应N2+O2  2NO在密闭容器中进行,下列哪些条件能加快反应的速率
2NO在密闭容器中进行,下列哪些条件能加快反应的速率
A. 缩小体积使压强增大 B. 体积不变充入N2使压强增大
C. 体积不变充入H2使压强增大 D. 压强不变充入N2使体积增大
解析:对有气体参加的化学反应,增大压强如果能增大反应物的浓度,则可以加快反应速率,AB均如此。C选项充入氢气,虽然压强增大,但反应物浓度不变,D选项体积增大,减小了氧气的浓度,也不加快反应。答案:AB。
[例2]温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量浓度增加了0.3mol,则此反应的平均速率 (x)为
A、v(O2)=0.01mol/(L·s) B、v(NO)=0.08mol/(L·s)
C、v(H2O)=0.003mol/(L·s) D、v(NH3)=0.002mol/(L·s)
解析:根据化学方程式4NH3+5O2 4NO+6H2O,NO的物质的量增加了0.3mol,则H2O增加了0.45mol,NH3和O2分别减少了0.3mol和0.375mol。所以,用反应中各气态的反应物和生成物表示的该反应的化学反应速率分别为:
v(NH3)= =0.002mol/(L·s) v(O2)= =0.0025mol/(L·s)
v(NO)= =0.002mol/(L·s) v(H2O)= =0.003mol/(L·s)
可见,本题的正确答案是CD。
[例3]一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
A. X、Y、Z的物质的量之比为1:2:2 B. X、Y、Z的浓度不再发生变化
C. 容器中的压强不再发生变化 D. 单位时间内生成n molZ,同时生成2n molY
解析:达到化学平衡状态是指各组分浓度不变的状态,此时本题中压强也不再变化,而D选项表示反应向逆反应方向进行,没有达到平衡。答案:BC。
[例4]一密闭容器内装有N2和H2 ,反应开始时,N2浓度为2 mol/L,H2浓度为5mol/L ,两分钟后,测得N2浓度为1·8mol/L ,则两分钟内N2的平均反应速率是多少?H2和NH3的平均反应速率又分别是多少?通过计算,比较三者速率有何联系?
解析: N2 + 3 H2  2NH3
2NH3
起始浓度(mol/L) 2 5 0
浓度变化(mol/L) 0·2 0·6 0·4
2 min后浓度(mol/L) 1·8 4·4 0·4
所以:v(N2)=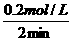 =0·1 mol/(L·min)
=0·1 mol/(L·min)
v(H2)=0·3 mol/(L·min) v(NH3)=0·2 mol/(L·min)
知能训练
4、采用不同的溶剂可改变反应速率
研究溶液中反应要考虑溶剂分子所起的物理的或化学的影响。溶剂的极性对反应速率存在影响。如果生成物的极性比反应物大,则在极性溶剂中反应速率比较大;反之,如反应物的极性比生成物大,则在极性溶剂中的反应速率必变小。如甲醇羰基化反应,在非极性溶剂中、介电常数较小的溶剂能增加反应速率;另如CH3COCl与苯酚反应当以硝基苯为溶剂时主要产品为对位,当以CS2为溶剂时主要产品为邻位。CH3CH2Cl在NaOH水溶液中发生水解反应,在NaOH醇溶液中发生消去反应。
3、电化学原理增大反应速率
在相同条件下,电化学反应比化学反应的反应速率快得多。如粗锌跟盐酸反应速率比纯锌快,这是由于粗锌中杂质与Zn构成原电池加快反应速率,不纯金属易被腐蚀原因也由于杂质(C)与金属(Fe)构成原电池。利用电化学原理也可使几乎不发生反应能进行反应,如铜与盐酸反应,可设计成原电池,也可设计成电解池。另如在水中加入强酸或强碱都可使电解水的速率加快。人们可利用电化学原理增大有利的化学反应速率,也可利用电化学原理减弱有害的化学反应速率,如牺牲阳极保护金属法。
2、加大光照强度提高反应速率
氯水、AgBr、HClO、浓HNO3等见光分解加快,强光照射H2与Cl2混合气体、甲烷与Cl2混合气体易发生爆炸等。光照还是光化学烟雾形成的主要原因,光化学烟雾是氮氧化物和碳氢化合物(CXHY)在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物。
1、增大表面积可提高反应速率
一定量的固体,其颗粒越小,表面积越大,反应中碰撞的机会越多,反应越快。如燃煤时将大块的煤粉碎后再燃烧可以使煤燃烧得更快、更充分;将硫铁矿粉末高温燃烧;铜丝与硫粉加热反应;与盐酸反应时,大理石粉比大理石块的反应更剧烈;面粉厂车间遇火种易发生爆炸等。
2.活性中心吸附论
合成氨中铁做催化剂时,铁在适当温度,例如500℃-550℃时做为活性中心,吸附氮分子,使氮分子的化学键变弱,进而使化学键破裂而离解为氮原子。气体氢分子与铁表面吸附的氮原子作用,逐步反应形成氨,可表示为:
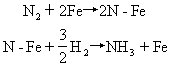
上述反应过程需要的活化能降低了,使活化分子百分数增高,因而反应速率大大增加。
在有气体参加的反应中,使用催化剂,由于催化剂中心的吸附产生中间产物,并使反应物在活性中心周围的浓度增大,活化分子增多,有效碰撞机会增大,从而使反应速率增大。以上两个学说是与有效碰撞理论有关的。
1.中间产物论
例如:二氧化锰催化氯酸钾的分解反应,二氧化锰亦参加了化学反应,形成了中间产物。
首先是氯酸钾和二氧化锰生成高锰酸钾、氯气和氧气:
2KClO3+2MnO2====2KMnO4+Cl2+O2
高锰酸钾进一步分解:
2KMnO4====K2MnO4+MnO2+O2
形成的锰酸钾与氯气反应:
K2MnO4+Cl2====2KCl+MnO2+O2
总起来为:
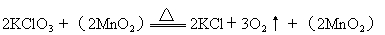
由于二氧化锰参加反应,使得活化能降低,从而大大加快反应速率。
这一理论对实验室制氧气时产生的现象能很好地解释。例如制造出的氧气有氯气的味道。最后剩余产物溶于水后的溶液呈淡紫色。说明中间产生氯气和高锰酸钾有一定的道理。
据研究,在一定温度下,气体分子具有一定的平均能量,但不是所有分子都具有这样大的能量的,有的分子能量高些,有的分子能量低些。只有极少数具有能量比平均值高得多的分子,它们才能发生有效的碰撞;也就是说,碰撞后才能引起反应,这样的分子叫做活化分子。活化分子具有的最低能量,与同温度下分子的平均能量之差叫做活化能,这是反应物分子在一定条件下进行反应,所必须具备的能量。不同的反应,具有不同的活化能,反应的活化能越低,活化分子的百分数就越大,反应就越快。活化能的单位通常是kJ/mol。例如,实验测得:
2SO2+O2=2SO3反应的活化能为209kJ/mol
2N2O5=4NO2+O2反应的活化能为100.32kJ/mol
活化分子和活化能的概念,可用来解释浓度、温度等因素对反应速率的影响。对某一反应来说,在一定温度下,活化分子在反应物分子中所占的百分数是一定的。因此,单位体积内活化分子的数目,是和单位体积内反应物分子的总数成正比,也就是和反应物的浓度成正比。显然,当反应物的浓度增大时,单位体积内活化分子的数目也相应地增多,这样也就增加了单位时间内有效碰撞的次数,因此反应速率加快。另外,如果升高反应温度,则分子运动加快,从而增加了单位时间内分子间的碰撞次数;更重要的是由于一些分子获得了能量,增加了活化分子的百分数,因而加快了反应速率。
至于催化剂加快反应速率的原因,乃是由于降低了反应的活化能,增加了活化分子的百分数的缘故。
4、影响化学平衡的条件:
化学平衡状态是与外界条件有关的。外界某种条件改变时,使正、逆反应速率不等,平
衡混合物中各组成物质的百分含量(或浓度)也随之改变,原来的平衡被破坏直到建立新条
件下的另一种平衡状态。这种改变的过程,叫化学平衡的移动。影响化学平衡的主要条件有
______、______、_____。
疑难点拨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com