
题目列表(包括答案和解析)
1. 了解化学反应中的能量变化,并从化学键的断裂和形成角度加深对化学反应本质的认识。了解吸热反应、放热反应及其与反应物、生成物能量间的关系。
20.在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
19、某研究性学习小组研究过氧化钠跟水等物质的反应,进行如下实验:向盛有少量过氧化钠固体的试管中滴加水,直至气体不再放出,加入稀释,将所得溶液平均盛放在七支试管中,一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去;另六支试管中分别加入少量二氧化锰、氧化铜、土豆泥、生锈的铁钉、新鲜动物肝脏或用波长为320~380 nm的光照射后,又有气体放出,待气体放出后,再滴加酚酞,溶液变红,持久不褪色。请写出:
(1)过氧化钠跟水反应的化学方程式:a._____________;b.____________。
(2)加入二氧化锰等后溶液中发生反应的化学方程式是________________________,反应中二氧化锰、氧化铜、土豆泥、生锈的铁钉、新鲜动物肝脏的作用是___________________。
(3)新鲜动物肝脏的提取液稀释10倍与原溶液实验效果基本相同,这表明新鲜肝脏对该反应具有_______________________。
A.专一性 B.多样性 C.高效性 D.稳定性
18.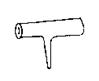 实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
实验室里常见到右图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验。当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点。
(1)用此仪器不能反复进行的实验是 (填序号)
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷一定温度下互相转变
D.无水CuSO4和胆矾的互变实验
(2)当玻璃管内装有NO2和N2O4的混合气体时,亦可反复进行反应条件对化学平衡影响的实验,该实验的操作过程和实验现象是 。
(3)如果玻璃管内装有大量红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是 ,如果玻璃管内封有少量无色溶液,加热溶液时,溶液变红,冷却后恢复无色。此溶液可能是 。
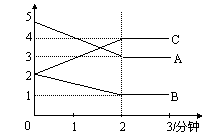
17.某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示。则该反应的化学方程式为 ;反应开始至2分钟,能用C表示反应速率吗? (填“能”或“不能”),原因 。
16.可逆反应aA(g)+bB(g)  cC(g)+dD(g),取a mol A和b mol B置于V L容器内1 min后,测得容器内A的浓度为x
mol·L-1,这时B的浓度为
,C的浓度为
,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为
。
cC(g)+dD(g),取a mol A和b mol B置于V L容器内1 min后,测得容器内A的浓度为x
mol·L-1,这时B的浓度为
,C的浓度为
,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为
。
15、分析下列实例,根据已有的知识和经验,填写下表。
|
实例 |
影响速率的因素 |
如何影响 |
|
夏天食物易变质 |
|
|
|
硫在氧气中比在空气中燃烧快 |
|
|
|
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 |
|
|
|
氯酸钾与二氧化锰混合共热可快速产生氧气 |
|
|
|
工业合成氨通常要在高压下进行 |
|
|
14、温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量浓度增加了0.3mol,则此反应的平均速率
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量浓度增加了0.3mol,则此反应的平均速率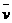 (x)为
(x)为
A、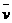 (O2)=0.01mol/(L•s) B、
(O2)=0.01mol/(L•s) B、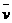 (NO)=0.08mol/(L•s)
(NO)=0.08mol/(L•s)
C、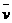 (H2O)=0.003mol/(L•s) D、
(H2O)=0.003mol/(L•s) D、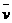 (NH3)=0.002mol/(L•s)
(NH3)=0.002mol/(L•s)
13、空气中煅烧硫铁矿可以产生SO2和氧化铁。为了提高生产SO2的速度,下列措施可行的是
A、把块状矿石碾成粉末 B、增大O2压强,向炉内喷吹空气
C、添加氧化铁作催化剂 D、降低温度并降低SO2浓度
12.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A、v正(N2)=v正(H2) B、v正(N2)=v逆(NH3)
C、2v正(H2)=3v逆(NH3) D、v正(N2)=3v逆(H2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com