
题目列表(包括答案和解析)
4.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
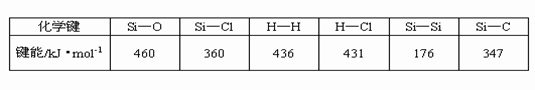
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC_______Si;SiCl4________SiO2
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。

(3)工业上高纯硅可通过下列反应制取:
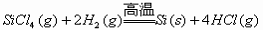
该反应的反应热△H =______ kJ/mol
[课后训练]
3.磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XkJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量为 。
(2)已知单质磷的燃烧热为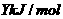 ,则
,则 P与O2反应生成固态
P与O2反应生成固态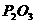 的反应热
的反应热 =
。
=
。
(3)写出 与
与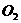 反应生成固态
反应生成固态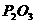 的热化学方程式:
。
的热化学方程式:
。
2.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol
4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+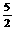 O2(g)
O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol
2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol
4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol
4CO2(g)+2H2O(l);△H=b kJ/mol
1.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-89.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
A H2(g) B CO(g) C C8H18(l) D CH4(g)
3.命题趋势
运用化学反应的能量变化知识去观察生活、生产和社会中的各类有关化学能源问题。预计考查反应热的内容将不断拓宽,难度会有所提高,题型也会有新的变化,如实验题中会考中和热的测定等。
[专题训练]
2.解题注意点
认真审题,在明确解题时需要运用哪些化学反应的能量变化知识的前提下,再根据题目所提供已知条件和要求,寻找合理的解题思路和思考方法,进行分析,推理,判断。
1. 方法与技巧
(1)对于化学反应的能量变化概念辨析题,一般要联系吸热反应,放热反应,反应热,燃烧热,中和热等概念,采用“原始概念对照法”,“”举例论证法 ,“分析判断法”进行推理判断。
(2)对于化学反应的能量变化计算题,要将热化学反应方程式的含义与物质的量计算相结合,一般采用“分析推理法”,“观察法”,“十字交叉法”以及“关系式法”解决有关化学反应的能量变化的计算题。
4. 初步认识使用化石燃料的利弊及新能源的开发,认识提高燃料利用率的途径和方法,逐步培养学生综合分析问题的能力,并逐步树立经济效益的观念。
[典型例析]
例1 已知甲烷的燃烧热为890.3kJ/mol。氢气的燃烧热为285.8kJ/mol。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2kJ,则该混合气体中碳原子和氢原子的个数比为
A.1:8 B.8:1 C.4:17 D.17:4
解析:要求C、H原子个数比,就必须求CH4、H2的分子个数比即物质的量之比。题目给出里CH4、H2的总物质的量和它们燃烧时放出的总热量,故可用联立方程组的方法求解。
设混合气体中含CH4物质的量为x,H2的物质的量为y,则有

所以原混合气体中C、H原子个数比为
8:(4×8+2×1)=4:17
所以答案应选C。
点评:本题是燃烧热计算中比较典型的例题。了解燃烧热的含义,掌握一定的计算方法技巧,是正确迅速求解的关键。
例2 现在城市居民使用的管道煤气的主要成分是:H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表所示
|
物质 |
H2 |
CO |
CH4 |
|
燃烧热(kJ/mol) |
285.8 |
283.0 |
890.3 |
(1)请写出H2、CO和CH4燃烧的热化学方程式。
(2)作为开发西部的西气东输工程的重要成就,西部天然气已全面进入上海、江苏境内,陆续成为城市居民使用的主要能源。使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大 (空气或天然气)的进入量或减少 (空气或天然气)的进入量。据报道,同时燃气价格也将在现有的0.95元/m3基础上调整到1.31元/m3,请通过计算说明若居民保持生活水平不变,在消耗燃气方面的消费大约是现在的 倍
解析:燃烧热是指完全燃烧1mol可燃物生成稳定物质所释放的能量,因此燃烧产物应为CO2和液态H2O,结合热化学方程式的书写注意点,不难写出正确的热化学方程式。
由燃烧方程式可见,1molH2或CO完全燃烧均需消耗0.5molO2,而1molCH4完全燃烧需消耗2molO2,显然改烧天然气使应增大空气进入量或减少天然气进入量。
生活水平不变,即每天需要的热量相等,不妨假设需要的热量为890.3kJ,分别计算需要煤气或天然气的量,进而算出价格比1.31/{(890.5/284.4) ×0.95}=0.44
答案:
(1)H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890.3kJ/mol
(2)空气 天然气 0.44
点评:将能量变化与实际生活相结合,应是今后化学试题命题的方向。
例3 已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
A. Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C. Q2< Q1< 92.4kJ D. Q2 = Q1 < 92.4kJ
解析:题给热化学方程式中的△H=-92.4kJ/mol是指1molN2(g)和3molH2(g)和完全反应的反应热。而将1molN2(g)和3molH2(g)在一定条件下反应时,是一个可逆反应,不可能全部反应,故反应放出的热量应小于92.4KJ。另一容器中的反应建立的平衡与前一容器建立的平衡应为等效平衡,平衡时各物质的量相等,但由于第二种情况下,容器中已有0.1molNH3,故反应再生成的NH3较第一种情况少,故Q2<Q1
答案:C
点评:本题不仅考查了反应热的概念,还同时考查了可逆反应,等效平衡等概念,综合性较强,考生只有在准确理解上述概念的基础上,才能准确做答。由于“化学反应中的能量变化”,新教材已将其作为另一条主线贯穿于教材始终,故能量变化问题几乎可与任何一章相联系、相综合,复习中应多加留意。
[方法归纳]
3. 了解燃烧热、中和热概念。掌握有关燃烧热的简单计算,学会在实验室进行中和热的测定。
2. 了解热化学方程式的意义,熟练掌握热化学方程式书写和应用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com