
题目列表(包括答案和解析)
10.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ; △H= -57.3kJ/mol 已知: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ; △H= -Q1kJ/mol H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) ; △H= -Q2kJ/mol HNO3(aq)+KOH(aq)+H2O(l) ; △H= -Q3kJ/mol
上述反应均为在溶液中进行的反应,则Q1、Q2、Q3的关系正确的是 ( )
A. Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 C. Q2 > Q3 > Q1 D. Q2 = Q3 > Q1
9. 下列热化学方程式中△H代表燃烧热的是( )
A. 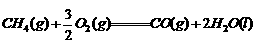 ; △H1
; △H1
B. 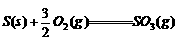 ;
△H2
;
△H2
C.  ; △H3
; △H3
D. 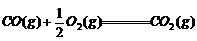 ;
△H4
;
△H4
8. 已知下列两个热化学方程式:
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ/mol
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53kJ的热量。则炭与氢气的物质的量之比是( )
A. 1:1 B. 1:2 C. 2:3 D. 3:2
7. 今有如下三个热化学方程式:
H2(g)+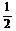 O2(g)=H2O(g);△H =a kJ/mol
O2(g)=H2O(g);△H =a kJ/mol
H2(g)+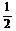 O2(g)=H2O(l);△H =b kJ/mol
O2(g)=H2O(l);△H =b kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H =c kJ/mol
关于它们的下列表述,正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. 反应热的关系:a=b D. 反应热的关系:2b=c
6. 一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )
A. 0.5Q B. Q C. 2Q D. 5Q
5. 下列说法正确的是( )
A. 1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热
B. 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
C. 由C(石墨)→C(金刚石);△H = +119 kJ/mol 可知,金刚石比石墨稳定
D. 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
4. 航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化引发高氯酸铵反应,其方程式可表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑;△H<0 下列对此反应的叙述中错误的是( )
A. 上述反应属于分解反应
B. 上述反应瞬间产生大量高温气体推动航天飞机飞行
C. 反应从能量变化上说,主要是化学能转变为热能和动能
D. 在反应中高氯酸铵只能起氧化剂作用
3. 下列选项中说明乙醇作为燃料的优点的是( )
① 燃烧时发生氧化反应 ② 充分燃烧的产物不污染环境
③ 乙醇是一种再生能源 ④ 燃烧时放出大量的热
A. ①②③ B. ①②④ C. ①③④ D. ②③④
2. 中国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉好处在于( )
A. 增大煤炭燃烧时的燃烧热并形成清洁能源B. 减少炉中杂质气体(如SO2等)的形成
C. 提高煤炭的热效率并减少CO的排放D. 使得燃料燃烧充分,从而提高燃料的利用率
1. 为减少汽车对城市大气的污染,近年来中国成功地开发了以新燃料作能源的“绿色汽车”。这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳烃的排放,保护环境。这种“绿色汽车”的燃料是( )
A. 甲醇 B. 油 C. 柴油 D. 重油
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com