
题目列表(包括答案和解析)
3.用电子式表示出离子化合物的形成过程。
用电子式表示MgO、K2S形成过程:___________、___________。
注意:
(1)首先考虑箭号左方原子的摆放,并写出它们的电子式。
(2)箭号右方写离子化合物的电子式。写时要注意二标:标正负电荷、阴离子标[]。
(3)箭号左方相同的微粒可以合并写,箭号右方相同的微粒不可以合并写。
(4)在标正负电荷时,特别要注意正负电荷总数相等。
2.电子式:_______________的式子。
原子电子式:H___ Cl___ S___ Ar___ Mg___
离子电子式:Na+__ Mg2+__OH-___NH4+__。
1._______________所形成的化学键叫做离子键。
成键微粒:____;相互作用:________;成键过程:________。
举例哪些物质能提供阴、阳离子:_______________、_______________、_______________。
17. 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”、“无影响”)。
16. 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应反应,生成氮气和水蒸气,放出256.652kJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
15. 已知下列热化学方程式:
 ;△H=-258.8kJ/mol
;△H=-258.8kJ/mol
 ;△H=-2220.0kJ/mol
;△H=-2220.0kJ/mol
5mol 和
和 的混合气体,完全燃烧时放热3847kJ,则混合气体中
的混合气体,完全燃烧时放热3847kJ,则混合气体中 和
和 的体积比为多少?
的体积比为多少?
14. 1836年俄国化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关。按此规律,结合下述反应方程式,填空。
已知:
(1) ;△H=-176kJ/mol
;△H=-176kJ/mol
(2) ;△H=-35.1kJ/mol
;△H=-35.1kJ/mol
(3) ;△H=-72.3kJ/mol
;△H=-72.3kJ/mol
(4)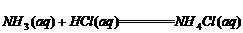 ;△H=-52.3kJ/mol
;△H=-52.3kJ/mol
则(5) ;△H=_____________。
;△H=_____________。
13.一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔溶于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
(1)上述潜热材料中最适宜应用的两种盐是(用化学式表示) 。
(2)实际应用时最常采用的(由来源和成本考虑)应该是 。
12. 0.3mol气态高能燃料乙硼烷( )在氧气中完全燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量。
)在氧气中完全燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量。
(1)乙硼烷的燃烧热为______________________.
(2)乙硼烷燃烧的热化学方程式为____________________________。
11. 已知下列热化学方程式:
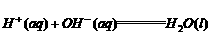 ;
;
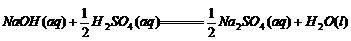 ;
;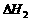
则 与
与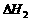 的关系是_______________________________________。
的关系是_______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com