
题目列表(包括答案和解析)
1、形成条件不同:离子键只有在易失电子的活泼金属元素(ⅠA、ⅡA)的原子与易获得电子的活泼非金属(卤素、氧、硫等)的原子间形成;共价键主要存在于同种非金属元素、不同种非金属元素或金属性较弱的金属元素与非金属性较弱的非金属元素的原子间。
元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。离子键没有方向性和饱和性。由离子键形成的化合物称离子化合物。在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。共价键是靠共用电子对形成的化学键,具有方向性和饱和性。分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。形成极性键时,有如下两种情况:
化学键的极性是分子极性产生的原因之一。当分子中所有化学键都是非极性键时,分子为非极性分子。当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
现列举说明如下:
|
键的极性 |
代表物 |
分子空间构型对称性 |
分子的极性 |
|
非极性键 |
N2、CI2、O2 |
直线型;对称 |
非极性分子 |
|
极性键 |
HCI、 HBr |
直线型、不对称 |
极性分子 |
|
CO2、CS2 |
直线型;对称 |
非极性分子 |
|
|
H2O、H2S |
折线型、不对称 |
极性分子 |
|
|
BF3 |
平面三角型、对称 |
非极性分子 |
|
|
NH3 |
三角锥型、不对称 |
极性分子 |
|
|
CH4、CCI4 |
正四面体;对称 |
非极性分子 |
3.分子间作用力 :分子间作用力存在于:________之间。 化学键存在于:________原子之间。氢键是一种分子间作用力,影响物质的____,如H2O由于分子间氢键的形成,分子间作用力骤然增强,从而改变了Te-S氢化物熔沸点降低的趋势而猛然升高,卤族中的HF和氮族中的NH3也有类似情况。
疑难点拨
2、极性分子:分子中由于电子云分布不均匀而呈极性的分子。由极性键结合形成的分子,正、负电荷重心不重叠,产生正、负极,分子结构不对称,属于分子极性分子。如:HCl、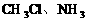 。
。
1、非极性分子:分子中电子云分布均匀,分子结构对称的分子属于非极性分子。只由________分子。如: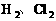 。由________也属于非极性分子。如:
。由________也属于非极性分子。如: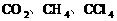
(1)键长:__________________核间距离。
键长决定分子的稳定性,一般说来,键长越___,键越___,也越稳定。键长的大小与成键微粒的半径大小有关。如键和H-Cl_H-Br_H-I,则稳定性:H-Cl_H-Br_H-I。
(2)键能:拆开1 mol某键所需的能量叫键能。单位:_____。键能决定分子的稳定性,键能越_,键越_,分子越_。
(3)键角:________的夹角。
键角决定分子的空间构型,凡键角为180°的为_____,如: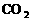 ;凡键角为109°28′的为_____体,如:
;凡键角为109°28′的为_____体,如: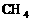 。
。
4.化学键:使离子相结合或原子相结合的作用。
注意:①化学键存在分子内②化学键是一种较强的相互作用
He、Ar、Ne、等稀有气体分子中是否存在化学键?______
3.非极性键与极性键
(1)非极性键:_____________________,存在于______。
(2)极性键:______________________,存在于______。
2.用电子式表示共价分子的形成过程。
用电子式表示I2、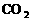 、H2O、H2S、NH3的形成过程:
、H2O、H2S、NH3的形成过程:
I2:____________;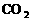 :____________;H2O:____________;H2S:____________;NH3:____________。
:____________;H2O:____________;H2S:____________;NH3:____________。
1、概念:____________叫共价键。
写出 的电子式和结构式。
的电子式和结构式。
___、____、____、____、____、____、____、____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com