
题目列表(包括答案和解析)
2、守恒法--利用质量、元素(原子)、得失电子、电荷守恒计算
 化学式:正化合价总数=|负化合价总数|
化学式:正化合价总数=|负化合价总数|
物质 电解质溶液:所有阳离子所带正电荷总数=所有阴离子所带负电
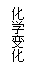
 荷总数
荷总数



 氧化还 单一反应:氧化剂得电子总数=还原剂失电子总数
氧化还 单一反应:氧化剂得电子总数=还原剂失电子总数
原反应 多个连续反应:找出化合价在变化前后真正变化的物
 质及所反应的量
质及所反应的量
 化学反应 离子反应:等号两边离子所带电荷数相等
化学反应 离子反应:等号两边离子所带电荷数相等

 电化学 阳(负)极失电子总数=阴(正)极得电子总数
电化学 阳(负)极失电子总数=阴(正)极得电子总数
串联的原电池(电解池),各极上转移电子数相等
气相反应:反应物总键能=生成物总键能+反应热
化学方程式

 宏观:参加反应 m(反应物)=反应生成 m(生成物)
宏观:参加反应 m(反应物)=反应生成 m(生成物)
质量守恒定律--
微观:元素种类不变,各元素原子个数守恒
利用守恒法解题可避免书写繁琐的化学方程式和细枝末节的干扰,直接找出其中特有的守恒关系,提高解题的速度和准确度。守恒法解题成功的关键在于从诸多变化和繁杂数据中寻找恒量对象关系。
例1、将含有O2和CH4的混合气体置于23.4克Na2O2的密闭容器中,电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中 ,无气体产生。
(1)残留物固体成分是什么?物质的量分别为多少?
(2)原混合气体中O2和CH4的物质的量之比为多少?
解析:
因容器中的压强为零 固H元素以H2O和NaOH 的形式存在 C元素以CO32- 的形式存在 总方程式为
xCH4+ yO2+23.4/78Na2O2=(2×23.4/78-2x)NaOH+xNa2CO3+(6x-2×23.4/78)/2H2O
利用氧元素守恒得
例2、有一在空气中暴露过的KOH固体,经分析知其中含水7.62%,K2CO3 2.88%,KOH 90%,若将此样品1克加入到46.00ml的1mol/l盐酸中,过量的酸再用1.07mol/lKOH溶液中和,蒸发中和后的溶液可得固体多少克?
解析:
此题中发生的反应很多,但仔细分析可知:蒸发溶液后所得固体为氯化钾,其Cl-全部来自于盐酸中的Cl-,在整个过程中Cl-守恒。即n(KCl)=n(HCl)可得结果。
例3、向100mlFeCl3溶液中通入标准状况下的H2S全部被吸收后,再加入过量铁粉,待反应停止后,测得溶液中含有0.6mol金属阳离子,则原FeCl3溶液的物质的量浓度为多少?
解析:
整个过程中Cl-不变化,最后溶液中的阳离子必为Fe2+0.6mol,则n(Cl-)=1.2mol,则n(FeCl3)=1.2/3mol=0.4mol,则:C(FeCl3)=0.4mol/0.1L=4mol/l
1、差量法--根据变化前后的差量列比例式计算
解题的一般步骤可分为:
①准确写出有关反应的化学方程式;
②深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强、密度、反应过程中热量的变化等,且该差量的大小与参加反应物质的有关量成正比;
③根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。
例1、(2004/4吉林二模)充分锻烧黄铁矿W克,反应完全后,冷却到室温,称的固体物质的质量是m g,生成SO2为V升,则黄铁矿中FeS2的含量是(假设矿石中的杂质受热不分解,也不会与SO2反应)
A、60V/22.4W×100% B、22.4V/60W×100%
C、80V/22.4W×100% D、3(W-m)/W×100%
解析:
本题是考查“差量法”的选择型计算题,设黄铁矿中含FeS2的质量为X.利用固体差可的答案:D
例2、(全国89)18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250,经充分反应后排出气体,冷却,称得剩余固体质量为16.6g。试计算原混合物中NaOH的质量分数。
6、有关综合计算
 过量计算问题的分析讨论
过量计算问题的分析讨论
混合物计算和解题技巧
复杂化学式的确定方法
考查热点 无数据计算的解决方法
数据缺省型的计算方法
讨论型计算的解题思路
隐含条件题的解决方法
化学图象题的解题技巧
 认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和解决方法
认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和解决方法
解题策略 善于抓住化学与数学知识间的交叉点,运用所掌握的数学知识,通过对化学知识的分析,建立函数关系
5、有关化学方程式的计算
 运用计算技巧进行化学方程式的有关计算
运用计算技巧进行化学方程式的有关计算
考查热点 热化学方程式中反应热、中和热、燃烧热的计算
 深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有
深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有
解题策略 关守恒关系
搞清各解题技巧的使用条件和适用范围,读懂题目,正确选择
4、有关氧化还原、电化学的计算
 氧化产物、还原产物的确定及量的计算
氧化产物、还原产物的确定及量的计算
转移电子数、电荷数的计算
考查热点 电极析出量及溶液中的变化量的计算
有关氧化还原反应的其他典型计算
解题策略 关键在于根据得失电子总数相等,列出守恒关系式求解
3、有关反应速率、化学平衡的计算
 利用化学反应速率的数学表达式进行计算
利用化学反应速率的数学表达式进行计算
考查热点 各物质反应速率间的换算
有关化学平衡的计算
 加强对速率概念、平衡移动原理的理解
加强对速率概念、平衡移动原理的理解
解题策略 将等效平衡、等效转化法等分析推理方法与数学方法有机结合,在采用常规解法的同时,可采用极值法、估算法等解题技巧
2、有关溶液的计算
 有关溶质溶解度的计算
有关溶质溶解度的计算
有关溶液浓度(溶液的溶质质量分数和物质的量浓度)的计算
考查热点 有关溶液pH的计算
有关溶液中离子浓度的计算
 有关溶解度和溶液浓度的计算,关键要正确理解概念的内涵,理清相互关系一般可采用守恒法进行计算
有关溶解度和溶液浓度的计算,关键要正确理解概念的内涵,理清相互关系一般可采用守恒法进行计算
解题策略 有关溶液pH及离子浓度大小的计算,应在正确理解水的离子积、pH概念的基础上进行分析、推理。解题时,首先明确溶液的酸(碱)性,明确c(H+)或c(OH-)
1、有关化学量与化学式的计算
 有关物质的量、质量、气体体积、微粒数间的换算
有关物质的量、质量、气体体积、微粒数间的换算
|

|
|
 考查热点
分子式(化学式)、元素的质量分数
化合物中某元素的相对原子质量
考查热点
分子式(化学式)、元素的质量分数
化合物中某元素的相对原子质量

|
 有机物的分子式、结构式
有机物的分子式、结构式
有机反应中量的关系
阿伏加德罗定律及其推论的应用
 掌握基本概念,找出各化学量之间的关系
掌握基本概念,找出各化学量之间的关系
解题策略 加强与原子结构、元素化合物性质、有机物结构性质等相关知识的横向联系
找出解题的突破口,在常规解法和计算技巧中灵活选用
19、通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可
以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
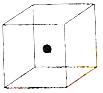 请回答下列问题:
请回答下列问题:
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; SiCl4 ______ SiO2
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4
(g) + 2H2(g)  Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
18. 1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 NO2-互为等电子体的分子有: 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com