
题目列表(包括答案和解析)
反应物的总能量>生成物的总能量,化学反应放出能量
反应物的总能量<生成物的总能量,化学反应吸收能量
化学键的断裂和形成是化学反应中能量变化的主要原因。
化学变化的过程伴随着化学能与其他能量的相互转化,这种变化,通常表现为热量的变化--吸热或放热。例如:中和反应是放热反应,H2与Cl2的反应也是放热反应。常见的吸热反应:大多数分解反应;氯化铵与八水合氢氧化钡的反应;
典例剖析
[例1] 近年来,科学家正在探索利用铝粉做燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的
A、 铝质轻,便于运输、贮存,且安全
B、 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C、 在地球上,铝矿资源丰富
D、现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
解析:铝质轻,燃烧时放热多,在地壳中是含量最大的金属元素,铝矿资源丰富,这些都是用铝作为新型燃料的有利条件,但是电冶铝本身需要消耗大量的能量,从这一点考虑,如果没有开发出新的冶炼金属铝的技术,则用铝作为新能源的做法是不合算的。所以D说法错误。答案:D。
[例2]最近,新华社的一条消息中披露:我国南海海底发现巨大的“可燃冰”带,能源总量估计相当于中国石油总量的一半;而我国东海“可燃冰”的蕴藏量也很可观……“可
燃冰”的主要成分是一水合甲烷晶体(CH4·H2O)。请结合初中化学知识回答下列问题:
(1)下列说法中正确的是(填序号)___________________________.
A.CH4·H2O晶体中水是溶剂 B.CH4·H2O的组成元素有3种
C.CH4·H2O中CH4和H2O的质量比为1:1 D.可燃冰能燃烧,说明水具有可燃性
(2)可燃冰的发现为我国在新世纪使用高效新能源开辟了广阔的前景.你认为能开发利用 的新能源还有(至少填写二种)__________________,__________________.
解析:(1)溶剂是能够溶解其他物质的物质,溶剂与溶质间没有固定的组成,而CH4·H2O的组成固定故A不正确.CH4中含C、H二元素,H2O中含H、O二元素,故CH4·H2O由C、H、O三元素,组成B正确.CH4·H2O分子中CH4与H2O的物质的量之比为1:1,而其式量不等则C
不正确.CH4·H2O可燃是由于分解产生CH4的原因,故D不正确.
(2)新能源是指以新技术为基础,系统开发利用的能源包括太阳能、生物能、风能、
地热能、氢能源等.
答案:(1)B (2)太阳能、潮汐能、水能、风能、核能、地热、氢能源等.
[练习] 为减少汽车对城市大气的污染,近年来中国成功地开发出了以新燃料作能源
的“绿色汽车”.这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳烃的排放,保护环境.这种“绿色汽车”的燃料是
A.甲醇 B.汽油 C.柴油 D.重油
答案: A
[例3]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
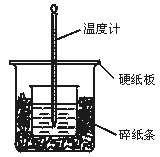
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________.
(2)烧杯间填满碎纸条的作用是_____________________________________________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”“偏小”
“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上
述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热_________(填“相等”“不相等”),简述理由_____________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会__________________.(均填“偏大”“偏小”“无影响”)
解析: 本实验成败的关键是准确测量反应后的温度.因此所用装置必须保温、绝热且可使体系温度尽快达到一致,故缺少的仪器应为环形玻璃搅拌棒.(2)碎纸条的作用为减少实验过程中的能量损失.(3)不盖硬纸板会损失部分热量故所测结果偏低.(4)由中和热概念可知,中和热只与生成水的量有关而与过量的酸碱无关,但液体体积增大温差减小,不便测
量.(5)由于弱酸弱碱的中和热等于H+与OH-生成H2O时的反应热加上其电离时吸热.
答案: (1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小 (4)不等 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的
用量无关 (5)偏小 偏小
思考: 要想提高中和热测定的准确性,实验应注意什么?
答案: (1)搅拌或倾倒时不要有溶液损失;(2)准确读取混合液的最高温度值;(3)溶液浓度不能太浓或太稀。
知能训练
在化学反应中,从反应物分子改变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变.在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了,在破坏旧化学键时,需要能量来克服原子间的相互作用,在形成新化学键时,由于原子间的相互作用而放出能量、化学反应的热效应来源于反应过程中
断裂旧化学键并形成新化学键时的能量变化。化学键键能的大小可粗略计算化学反应的热效应。化学反应的热效应ΔH=生成物的键能总和-反应物的键能总和。
疑难点拨
放热反应:___________;吸热反应:___________。
2Al+6HCl=2AlCl3+3H2↑反应___热;Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O反应__热;H+ + OH- = H2O反应__热
键能:拆_________所需的能量叫键能。单位:____。1mol H2中含有1molH-H,在250C 101kPa条件下,由H原子形成1molH-H要放出436kJ的能量,而断开1molH-H重新变为H原子要________的能量。
1、化学键的断裂是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于____________________的相对大小。
∑E(反应物)>∑E(生成物)--______能量;
∑E(反应物)<∑E(生成物)--______能量。
20.在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是多少?
(2) 通过导线的电子的物质的量是多少?
19.有A、B两种金属分别与盐酸反应,产生氢气的速率相近。怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图)
18、请设计一个原电池,其总反应为:Zn + 2FeCl3 = ZnCl2 + 2FeCl2。
17、市场上出售的“热敷袋”其中主要成分是铁屑、碳粉和少量的NaCl、水等.热敷袋在启用前用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓,就会放出热量,使用完后,会发现袋内有许多铁锈生成,回答:
(1)热敷袋放出的热量来源于 放出的热量.
(1)碳粉的作用是 .
(3)加入NaCl的作用是 .
(4)写出有关的电极反应式和化学方程式 .
16、某同学想测定A、B、C三种金属活动顺序,他把这三种金属放到相同物质的量浓度的盐酸中,反应速率都较慢,不易分辨出三者差异,现只有盐酸一种化学试剂,应该用什么方法迅速测出三种金属的活动性顺序?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com